Является ли высокожирная или кетогенная диета вредной для вашего кишечника?
BY LUCY MAILING, MD/PHD
Кетогенные диеты становятся все более популярными для всего: от потери веса до лечения рака. Многие люди выразили обеспокоенность по поводу того, какое влияние эта диета оказывает на здоровье кишечника и кишечный микробиом. Но действительно ли диета с высоким содержанием жиров означает катастрофу для кишечника? В этой статье вы узнаете, почему исследования на животных вводят в заблуждение, о чем говорит текущее исследование, и почему кетоз может даже улучшить здоровье кишечника в некоторых случаях.
Если вы уже некоторое время читаете мой блог, вы знаете, что я сторонник низкоуглеводной, высокожирной или кетогенной диеты для различных состояний. Кетогенная диета становится все более популярной для снижения веса, регуляции уровня сахара в крови, нейродегенеративных заболеваний и даже в качестве компонента лечения рака. Другие, в том числе и я, выбирают кетогенную диету ради ясности ума и повышения продуктивности.
В последние месяцы я получила много вопросов о том, как кето влияет на здоровье кишечника и кишечного микробиома. Похоже, существует широко распространенное мнение, что единственное, что питает полезные кишечные микробы, — это сложные углеводы, и что если у нас нет бутирата в результате ферментации пищевых волокон, наш кишечный барьер страдает.
Но так ли это на самом деле? В этой статье я углублюсь в исследования и предложу полное обсуждение доказательств, включая и рассказ о том, что мы не знаем.
На самом деле мы не знаем, что представляет собой «здоровый» микробиом.
В последние месяцы я получила много вопросов о том, как это влияет на здоровье кишечника и кишечного микробиома. Кажется, существует широко распространенное мнение, что единственное, что питает полезные кишечные микробы, — это сложные углеводы, и что если у нас нет бутирата от ферментации пищевых волокон, наш кишечный барьер тоже страдает. Но так ли это на самом деле? В этой статье я углублюсь в исследование и предоставлю полное обсуждение доказательств, включая то, что мы не знаем. Мы действительно не знаем, что представляет собой «здоровый» микробиом.
Новые технологии и растущий интерес к здоровью кишечника в последние годы значительно расширили наше понимание темы микробов кишечника, и теперь коммерческие компании позволяют любому взглянуть на мир микробов, который находится в их кишечнике. К сожалению, возбужденное отношение опережает исследования, и правда заключается в том, что мы очень мало знаем о том, что представляет собой «здоровую» кишечную микробиоту.
Если вы возьмете двух случайных людей, вы сможете у них найти в среднем только около трети похожей кишечной микробиоты. Другие две трети их кишечного сообщества будут значительно различаться в зависимости от генетики этих людей, географии проживания, истории употребления антибиотиков и лекарств, способа рождения, диеты и других факторов, которые, вероятно, еще предстоит обнаружить. У нас действительно недостаточно информации, чтобы сказать, что «две трети» одного человека лучше, чем «две трети» другого человека, если только у одного из них нет чрезмерного роста колонии бактерий или инфекции известным патогеном.
Вы могли бы сказать, ну, разве мы можем не смотреть на микробное разнообразие? Или стабильность микробного сообщества? Хотя обычно считается, что разнообразие и стабильность сообщества являются ключевыми компонентами здоровой кишечной экосистемы, даже они иногда могут быть связаны с болезненными состояниями.1,2 А некоторые из основных «полезных» микроорганизмов, которые считается что имеют решающие значение для здоровья микробиома, такие как бифидобактерии, иногда полностью отсутствуют в кишечнике людей традиционных культур, таких как люди племени Хадза,3и пока что эти популяции практически свободны от хронических заболеваний.
![]()
Мы рассмотрим эту тему с эволюционной перспективы подробнее в следующем разделе.
Микробиом кишечника развивался вместе с нами —
Наши отношения с кишечными микробами сегодня являются результатом эволюции на протяжении жизни тысячи поколений. В течение миллионов лет эволюция действовала не только на наши 23 000 человеческих гена, но и на почти 4 миллиона генов (как человеческих, так и микробных), которые присутствуют в наших телах и на них.4 Мы те, кто мы сегодня из-за того, как мы развивались вместе с нашими микробами.
Среда, в которой мы развивались, требовала регулярной адаптации к меняющимся условиям. Наши предки не всегда имели готовый доступ к еде и периодически голодали, когда еды было мало. Таким образом, наш организм обладает способностью сжигать и использовать углеводы, когда пищи в изобилии, и превращать диетический жир или накопленный жир в кетоны для энергии, когда пищи или углеводов мало. Это называется метаболической гибкостью.
Таким образом, реальный вопрос заключается в следующем: Как может случится, что наш организм обладает метаболической гибкостью, чтобы справляться с изменяющейся доступностью продуктов питания, а наш кишечный микробиом не обладает такой же метаболической гибкостью? Действительно ли наши предки развивали «нездоровый» микробиом каждый раз, когда крахмалистых углеводов становилось мало? Думаю, что нет.
Давайте также рассмотрим такие традиционные культуры как Инуиты. У Инуитов, которые ели очень мало растительной пищи, действительно ли был нездоровый микробиом? Или у них был микробиом, который был уникально адаптирован к их диете? Имели ли они проницаемость кишечника угрожающего масштаба и воспаление от своей высокожирной диеты? Или же у их кишечника также была форма метаболической гибкости, которая позволяла им выживать в основном на животном белке и жире?
Мы обсудим все основные механизмы на данный момент, но я хочу сказать следующее: «здоровый» микробиом — это просто тот микробиом, который есть у вас, когда вы здоровы»
. И то, что полезно для вас, может не быть полезным для кого-то другого.
Это одна из причин, почему я всегда подчеркиваю, что при рассмотрении проблем с кишечником я обращаю внимание на общую среду кишечника и текущие симптомы. Если у кого-то недостаточно разнообразная микробиота, но человек себя прекрасно чувствует, лечение его кишечника может ему скорее навредить, чем принесет пользу.
Но достаточно рассуждать — давайте погрузимся в данные исследований!
Исследования на животных, в которых используется «диета с высоким содержанием жиров», вводят в заблуждение
Если вы будете заниматься поисками в любой базе данных научной литературы, вы можете найти более ста исследований, которые показывают, что кормление животных «диетой с высоким содержанием жиров» приводит к массивному дисбиозу кишечника, развитию повышенной проницаемости кишечника и системному воспалению. Люди часто цитируют эти исследования, чтобы высказать предположение, что диета с высоким содержанием жиров также может быть вредна для микробиома кишечника человека.
Но посмотрите внимательнее на методы, и вы увидите, что «диета с высоким содержанием жиров», используемая в большинстве исследований на животных, более точно может быть названа диетой с высоким содержанием рафинированного соевого масла, сала и рафинированного сахара и очень низким содержанием клетчатки.5 Доктор Крейг Уорден, профессор UC Davis, назвал это «мышиным эквивалентом диеты, состоящей из свиной шкурки, ребер на гриле и кока-колы»6, полагая, что эта «диета с высоким содержанием жиров» гораздо больше отражает стандартную американскую диету, чем любая тщательно составленная кетогенная диета.
Кроме того, метаболизм человека может легко адаптироваться к диете с высоким содержанием жиров или углеводов. С другой стороны, естественная диета мыши с низким содержанием жира и высоким содержанием углеводов, поэтому неудивительно, что у мышей возникают проблемы при употреблении диеты, которая плохо соответствует тому, на чем они эволюционировали, в питании.
Более того, штамм мышей, наиболее часто используемых для таких исследований, это мыши C57Bl/6, был генетически отобран за способность набирать вес и повышать уровень глюкозы в ответ на «диету с высоким содержанием жиров». В то время как люди, как правило, демонстрируют большую потерю веса в ответ на низкоуглеводную диету, мыши C57Bl/6 имеют большую прибавку в весе и нарушения обмена веществ на диетах с низким содержанием углеводов. Наблюдая за этим, главные исследователи доктор Ричард Фейнман и доктор Сайхан Борхджид пришли к выводу:
«Результаты показывают, что модели ожирения у грызунов могут быть наиболее ценными в понимании того, как метаболические механизмы могут работать способами, отличными от воздействия на людей».7
Другими словами, идея о том, что мы можем перевести какие-либо результаты у этих выборочно выведенных мышей, которых кормили «диетой с высоким содержанием жиров», на людей, заботящихся о своем здоровье, придерживающихся кетогенной диеты, просто абсурдна, и грубое искажение результатов исследования.
Итак, давайте посмотрим вместо этого на исследование с участием человека.
(Кетогенная) диета быстро и воспроизводимо изменяет микробиом кишечника человека
В 2014 году David et al. опубликовал исследование в журнале «Nature», в котором здоровых добровольцев-людей помещали на краткосрочную диету на растительной или животной пище и продемонстрировали, что отдельные кишечные микробные сообщества появились всего за три дня.
![]()
![]()
Это было ключевое исследование в области исследований микробиомов, о котором я знала в течение некоторого времени (оно цитировалось более 2700 раз с 2014 года), но только когда я проводила исследование для этой статьи и случайно взглянула на дополнительные данные, при прочтении которых меня осенило: животная диета была кетогенной!
В то время как растительная диета включала 300 граммов углеводов в день из зерновых, овощей, риса, чечевицы и фруктов, животная диета включала менее 3 граммов углеводов в день, содержала 30% калорий из белка и 70% калорий от жира, поступающего из яиц, мяса и сыра. Это соотношение макронутриенотов соответствует кетогенной диете. Исследователи даже измерили кетоны в моче и подтвердили, что субъекты находились в кетозе ко второму дню животной диеты.
Многие люди говорят, что у нас нет таких исследований.
Так что же они нашли? У участников кетогенной диеты увидели увеличение микробного разнообразия. Они также наблюдали увеличение относительной численности микроорганизмов, устойчивых к желчи, таких как Bilophila, Alistipes и Bacteroides spp. и уменьшение относительной численности микробов, которые, как известно, метаболизируют сложные пищевые растительные волокна, такие как Roseburia, Eubacterium и Ruminococcus spp. Это не слишком удивительно.
«Наши выводы о том, что кишечный микробиом человека может быстро переключаться между травоядными и плотоядными функциональными профилями, могут отражать прошлые избирательные нагрузки в ходе эволюции человека. Потребление животной еды нашими предками, вероятно, было нестабильным, в зависимости от сезона и успеха стохастического кормодобывания, при этом легкодоступные растительные продукты предлагали запасной источник калорий и питательных веществ. Микробные сообщества, которые могли бы быстро и соответствующим образом изменить свой функциональный репертуар в ответ на изменение рациона, впоследствии повысили бы гибкость питания человека».
Другими словами, наша кишечная микробиота просто адаптируется к текущей доступности различных источников пищи — она не обязательно становится более или менее патогенной из-за количества углеводов или жиров в рационе.
Кетогенные диеты, вызванные изменениями в кишечном микробиоме, могут быть защитными при рассеянном склерозе
А как насчет долгосрочных исследований? В одном исследовании, опубликованном в журнале Frontiers in Microbiology в 2017 году, было изучено долгосрочное влияние кетогенной диеты на фекальную микробиоту у 25 пациентов с рассеянным склерозом.8
Рассеянный склероз (РС) является аутоиммунным заболеванием, которое поражает нервную систему. Как и многие аутоиммунные заболевания, РС связана с патологией кишечника. Фактически, некоторые исследователи подозревают, что дисбиоз кишечника и проницаемость кишечника могут в первую очередь предшествовать развитию аутоиммунитета.9 Таким образом, из этого следует, что если кетогенная диета может значительно улучшить симптомы РС,10 она, вероятно, не наносит вреда кишечнику и может даже улучшать здоровье кишечника.
Так что же нашло исследование? Пациенты с РС имели тенденцию к снижению уровня Roseburia, Bacteroides и Faecalibacterium prausnitzii в начале исследования по сравнению со здоровыми людьми. Затем они сели на кетогенную диету в течение 6 месяцев. Авторы пишут:
«Эффект кетогенной диеты был двухфазным. В краткосрочной перспективе бактериальные концентрации и разнообразие были еще более снижены. Они начали восстанавливаться на кетогенной диете на 12 неделе и значительно превысили исходные значения через 23–24 недели на кетогенной диете».8
Это говорит о том, что, хотя кратковременные изменения в рационе питания могут быстро изменить состав микробиоты кишечника, нам, возможно, потребуется проанализировать долгосрочные изменения рациона питания и собрать образцы в различные моменты времени, чтобы определить истинный эффект диетического вмешательства.
К сожалению, это исследование не измеряло симптомы или какие-либо другие показатели здоровья кишечника, поэтому мы не можем знать, была ли полезна кетогенная диета. Чтобы исследовать, является ли кетогенная диета полезной для кишечного микробиома, мы должны вернуться к хорошо разработанным исследованиям на животных.
Микробиом кишечника влияет на противоэпилептические эффекты кетогенной диеты.
Кетогенные диеты часто используются для лечения эпилепсии, которая не реагирует на медикаментозное лечение. Несмотря на невероятную эффективность, именно то, как кетогенная диета приносит пользу активности мозга, оставалось не до конца понятным в течение десятилетий. Тем не менее, новое исследование, опубликованное в журнале Cell в мае 2018 года, предполагает, что благотворное влияние кетогенной диеты опосредовано через микробиом кишечника!11 Другими словами, если кетогенная диета не изменяет микробиом, она не будет эффективной для предотвращения эпилептических судорог.
![]()
Исследование проводилось на мышиной модели эпилепсии (с использованием разных штаммов мышей, не того штамма, который я упоминала ранее). Как и в предыдущих исследованиях, это исследование смогло показать, что кормление мышей кетогенной диетой защищает их от судорог. Также исследователи продемонстрировали, что лечение мышей антибиотиками широкого спектра действия убирало защиту от судорог .
Другими словами, если кетогенная диета не изменяет микробиом, она не будет эффективной для предотвращения эпилептических судорог. Исследование проводилось на мышиной модели эпилепсии (с использованием других штаммов, чем тот, который я упоминал ранее). Как и в предыдущих исследованиях, они смогли показать, что кормление мышей кетогенной диетой защищает их от судорог. Они также продемонстрировали, что обработка мышей антибиотиками широкого спектра действия убирало защиту от судорог.
Аналогичным образом, стерильные мыши (со стерильным желудочно-кишечным трактом), которые выращиваются в стерильных инкубаторах и не имеют кишечного микробиома, не были защищены от судорог даже при употреблении кетогенной диеты. Интересно, что кетогенная диета в этом исследовании сократила микробное разнообразие, но увеличила численность Akkermansia muciniphila и Parabacteroides spp. Исследователи задавались вопросом, отвечают ли эти два микроба за защиту от судорог, и пытались лечить мышей, получавших нормальную высокоуглеводную пищу, препаратами Akkermansia muciniphila и Parabacteroides.
Удивительно, но это дало защиту от судорог. Дальнейшие механистические эксперименты идентифицировали бактериальный путь, который повышал отношение ингибирующего нейромедиатора GABA по отношению к возбуждающему нейромедиатору глутамату в мозге. ГАМК успокаивает активность в головном мозге, поэтому это объясняет снижение судорог и может также объяснить, почему многие люди находят кетогенную диету полезной для уменьшения беспокойства. Это может также объяснить, почему многие люди находят кетогенную диету полезной для уменьшения беспокойства.Но разве кето не снизит производство бутирата?
Разве кето не снизит производство бутирата?
Теперь, когда мы рассмотрели все соответствующие экспериментальные данные на людях и животных, которые мы имеем на сегодняшний день, я хочу немного рассказать о задействованных механизмах.
Во-первых, мы знаем, что ферментируемые углеводы необходимы для производства короткоцепочечных жирных кислот. Бутират жирных кислот с короткой цепью хорошо известен как «предпочтительный» источник топлива для клеток кишечного эпителия. У большинства современных людей он обеспечивает около 70 процентов энергетических потребностей эпителиальных клеток толстой кишки. И нам нужна регулярная подача бутирата для поддержания барьерной функции… так ведь?
Нет. Оказывается, что есть несколько других молекул, которые могут выполнять многие сигнальные функции бутирата и служить источником топлива для клеток кишечного эпителия! Фактически, эта идея «предпочтительного» источника топлива может быть искажена при изучении людей (и грызунов), которые едят большое количество углеводов.
Производство бутирата, несомненно, будет снижено при кетогенной диете, но другие молекулы могут занять его место, чтобы помочь поддерживать барьерную функцию кишечника.
Кетоновые тела и изобутират могут заменить бутират
Есть три молекулы, которые могут заменить бутират: изобутират, ацетоацетат и бета-гидроксибутират.
Изобутират — это метаболит белковой ферментации, который обычно вырабатывается в гораздо меньших количествах, чем бутират. Когда бутират отсутствует, изобутират может выводиться из просвета кишечника клетками кишечного эпителия и метаболизироваться для получения энергии. Было обнаружено, что изобутират повышен в исследовании, которое я упоминала выше, у тех, кто употребляет животную кетогенную диету.12
Кроме того, изобутират может стимулировать те же рецепторы, что и бутират в кишечнике (GPR41, GPR43 и GPR109a), что приводит к секреции слизи, выделению антимикробных пептидов и иммунной регуляции.13 И хотя изобутират может производиться на более низких уровнях на диете с умеренным высоким содержанием белка, чем бутират на диете с высоким содержанием углеводов,12 было показано, что изобутират является более мощным стимулятором GPR41 (FFAR3), одного из первичные рецепторы для бутирата, чем сам бутират!14 Другими словами, то, что изобутирату не хватает концентрации, может восполнить его потенцию.
Две другие молекулы, ацетоацетат и бета-гидроксибутират (βHB), являются двумя основными кетоновыми телами, вырабатываемыми печенью во время кетогенного состояния. Как и бутират, βHB также может стимулировать GPR109a, уменьшая воспаление кишечника. Однако, как β-HB, так и ацетоацетат, являются промежуточными звеньями в пути метаболизма бутирата. Другими словами, когда бутират поглощается клетками кишечного эпителия, он фактически сначала превращается в βHB, а затем в ацетоацетат, а затем подвергается дальнейшему расщеплению для получения энергии.
Посмотрите на рисунок ниже :
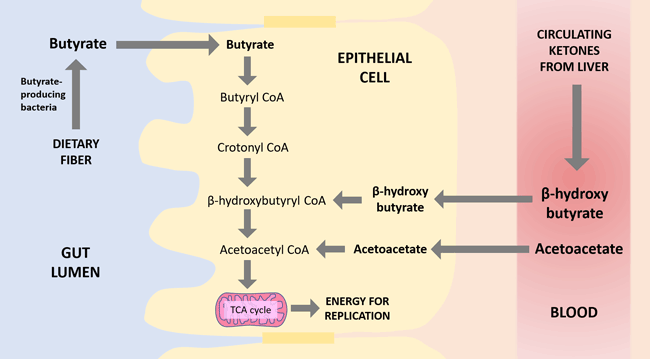
На первый взгляд, сокращение трех стадий метаболизма вроде не кажется большой проблемой, пока до вас не дойдет, что сероводород (H2S) ухудшает работу фермента, который катализирует первую стадию окисления бутирата,15 а многие люди с дисбиозом кишечника имеют избыточную продукцию H2S.
Получение субстратов из крови также, по-видимому, не имеет особого преимущества, пока вы не примете во внимание, что у многих людей с воспаленным кишечником имеется в наличии повреждение слизистой оболочки, когда поглощение бутирата нарушено .
Так что все это значит? Если вы в целом здоровы и у вас здоровое состояние кишечника, бутират отлично работает, чтобы удовлетворить все потребности кишечника и кетоны не нужны.
Однако , если вы :
• имеете язвенный колит или другие повреждения слизистой оболочки жкт, когда поглощение бутирата нарушено,
• имеете высокие уровни организмов , продуцирующих сероводород, что приводит к нарушению первой стадии окисления бутирата (преобладает у людей с IBS-D),
• имеете дисбиоз кишечника, характеризующийся отсутствием производителей бутирата , или
• имеете нарушение всасывания углеводов и находитесь на длительном низком уровне FODMAP или SCD, что приводит к снижению производства бутирата,
Может быть целесообразно попробовать терапевтический кетоз для поддержки метаболизма эпителиальных клеток кишечника, по крайней мере, до лечения патологий кишечника и заживления слизистой оболочки кишечника.
К сожалению, было проведено мало исследований кетогенной диеты при болезни Крона, язвенном колите или синдроме раздраженного кишечника. В одном случае было обнаружено, что палеолитическая кетогенная диета вызвала полную ремиссию у мальчика с тяжелой болезнью Крона.16 Второе исследование показало, что низкоуглеводная диета с добавлением кетонового эфира значительно уменьшает воспаление и улучшает качество жизни у пациента с болезнью Крона.17
Другое исследование 13 пациентов с синдромом раздраженной кишки с преобладанием диареи (IBS-D) показало, что 10 человек сообщили об ослаблении симптомов во время 4-недельной кетогенной диеты.18 К счастью, многие люди, страдающие язвенным колитом, получили облегчение от кетогенных диет, в том числе популярный медицинский блогер и биохимик Robb Wolf. Насколько мне известно, ни в одном исследовании не оценивалось влияние кетонов или кетогенной диеты на барьерную функцию кишечника. Это, безусловно, то, что я надеюсь изучать в своей лаборатории в будущем.
Но разве диеты с высоким содержанием жиров не увеличивают поглощение ЛПС(LPS)?
Другой распространенный аргумент в пользу того, чтобы избегать диет с высоким содержанием жиров, заключается в том, что они увеличивают всасывание в кишечнике липополисахарида (LPS), молекулы, обнаруживаемой в клеточных стенках грамотрицательных бактерий. Если LPS попадает в кровообращение, это может вызвать слабое системное воспаление.
Чтобы действительно понять этот механизм, мы должны рассмотреть, как жиры перевариваются и усваиваются. Когда мы едим жир, специализированные клетки тонкой кишки выделяют гормон холецистокинин (CCK). CCK стимулирует желчный пузырь выделять желчь в тонкую кишку. Здесь желчные кислоты окружают молекулы жира, что делает жиры растворимыми в воде (так же, как моющее средство для посуды помогает эмульгировать масло).
Оказывается, что ЛПС обладает высоким сродством к этим водорастворимым упаковкам, называемым мицеллами. Мицеллы в конечном итоге диффундируют к кишечному эпителию, где их содержимое (включая LPS) улавливается кишечными эпителиальными клетками. Эпителиальные клетки переупаковывают липиды и LPS в хиломикроны, которые затем могут быть экспортированы в печень через лимфатические сосуды.
Когда мы потребляем больше длинноцепочечных жирных кислот, наш организм вырабатывает больше этих хиломикронов, поэтому больше LPS может запутаться таким образом.19 Действительно, обогащенная жиром пища, как было показано, умеренно повышает сывороточный уровень LPS как у мышей, так и у людей.20,21 Хотя это абсолютно реальное явление и заслуживает рассмотрения, я считаю, что это, как правило, не проблема по нескольким причинам.
Во-первых, некоторые исследования предполагают, что транспорт LPS хиломикронами может давать преимущество, поскольку он способствует клиренсу LPS печенью, уменьшая токсичность LPS.22,23 Кроме того, хиломикроны также обладают врожденной способностью инактивировать ЛПС.24 В целом, увеличенное поглощение LPS, кажется, уменьшает воспаление в слизистой оболочке кишeчника.25
Это особенно важно, поскольку основной способ системного воздействия ЛПС — не поглощение жира, а протекающая кишка! Когда кишка проницаема, большие количества ЛПС могут протекать в подслизистую оболочку и кровоток, вызывая локализованные иммунные реакции кишечника и системное воспаление.
По сравнению с полноценной кишечной проницаемостью, индуцированная хиломикроном абсорбция LPS — это просто капля в море. (Фактически, для тех, кто имеет дело с тяжелой кишечной проницаемостью, детоксикация LPS, вызванная хиломикроном, может даже уменьшить воспаление, достаточное для облегчения заживления кишечного эпителия.)
Кроме того, если бы вызываемая жиром абсорбция LPS была проблемой, мы ожидали бы увидеть усиление системного воспаления у тех, кто питался кетогенной диетой с высоким содержанием жира. Напротив, субъекты, которых кормили кетогенными диетами, почти повсеместно испытывают уменьшение системного воспаления.26
Хорошо, надеюсь, к этому моменту я убедила вас, что не следует опасаться диеты с высоким содержанием жиров из-за отсутствия в них бутирата или повышенной абсорбции ЛПС.
Желчные кислоты имеют решающее значение для здоровья кишечника
Некоторые люди также полагают, что диета с высоким содержанием жиров может быть вредна для кишечной микробиоты и кишечного барьера, поскольку она стимулирует повышенную секрецию желчных кислот. Чем больше жира вы едите, тем больше желчи выделяется в тонкую кишку.
Действительно, некоторые исследования показали, что длительное воздействие на кишечный барьер высоких концентраций желчных кислот приводит к кишечной проницаемости. Однако было показано, что физиологические дозы желчных кислот поддерживают барьерную функцию, вызывая секрецию слизи из бокаловидных клеток, способствуя миграции эпителиальных клеток и усиливая иммунную защиту кишечника.27
![]()
Желчные кислоты также обладают антимикробными свойствами, помогая регулировать микробиоту кишечника, и могут особенно защищать от чрезмерного роста тонкого кишечника (SIBO).28 Некоторые исследования также предполагают, что желчные кислоты активируют энтероэндокринные клетки, чтобы выпустить серотонин, который помогает продвигать моторику кишечника.29
Исследование различий каждого типа конъюгированной и деконъюгированной желчной кислоты выходит за рамки этой статьи, и я надеюсь, что об этом я расскажу в следующем посте. В целом, я не верю, что есть достаточные доказательства, чтобы предположить, что физиологическое увеличение желчных кислот, наблюдаемое при кетогенной диете, вредно для микробиоты кишечника или барьерной функции кишечника.
А как насчет диеты плотоядных?
Диета плотоядных животных недавно рекламировалась как панацея от широкого спектра заболеваний. В то время как диета, состоящая полностью из мяса, может быть полезна в качестве краткосрочной терапевтической диеты, и, как ни странно, многие люди испытывают улучшение своих симптомов, существует ограниченное количество данных о долгосрочной безопасности этого диетического подхода.
Теоретически возможно получить все свои питательные вещества из животной диеты, предполагая, что вы едите от носа до хвоста и потребляете все части животного. Интересно, что краткосрочная диета на основе животных, представленная в исследовании, которое я упоминал выше, была связана с повышенной экспрессией бактериальных генов для биосинтеза витаминов.12 Как диета с низким содержанием остатков, уменьшение воспаления кишечника может также улучшить состояние питательных веществ в краткосрочной перспективе.
Тем не менее, мы очень мало знаем о том, как рацион плотоядных животных может повлиять на состояние питательных веществ, гормоны, фертильность и функцию щитовидной железы в долгосрочной перспективе.
Более того, нет никаких доказательств того, что какая-либо исконная популяция жила только на мясе или только растениях. Даже Инуиты и другие популяции, жившие на крайнем севере, шли на все, чтобы добывать растения, когда они могли или могли повысить свою фертильность другими способами. В своей книге «Питание и физическая дегенерация, сравнение примитивных и современных диет и их последствий» Уэстон А. Прайс писал:
«Среди индейцев в стране лосей возле Северного полярного круга больший процент детей родился в июне, чем в любой другой месяц. Мне сказали, что этот эффект был достигнут благодаря обоими родителями, которые от души ели щитовидную железу самцов лося, когда они спускались с высокогорных районов в течение брачного периода, когда большие выпуклости, где находится щитовидная железа под горлом, были значительно увеличены».
Другими словами, у этих культур была традиционная мудрость заниматься самолечением с щитовидной железой других животных, чтобы восполнить снижение фертильности, вызванное отсутствием растительной пищи. Большинство современных «карниворов» этого не делают, и многие употребляют в пищу только мышечное мясо.
Я, конечно, сочувствую тем, кто нашел, что диета плотоядных способна облегчить их симптомы. При этом, я полагаю, что в большинстве случаев терапевтическая кетогенная диета может быть столь же эффективной. Сказав это, я верю, что идеальная диета, вероятно, включает некоторое количество растительной пищи.
Подведение итогов и советы для поддержания здоровья кишечника на кетогенной диете
Подводя итог, можно сказать, что нет четких доказательств того, что хорошо продуманная диета с высоким содержанием жиров или кетогена вредна для микробиоты кишечника или барьерной функции кишечника. Фактически, кето-индуцированные изменения кишечной микробиоты и кишечного барьера могут даже быть причиной того, что мы видим так много преимуществ от кетоза.
Более того, мы на самом деле не знаем, из чего состоит здоровая микробиота кишечника , и кетоны могут заменить бутират жирной кислоты с короткой цепью, который мы обычно считаем крайне важным для барьерной функции кишечника. Несколько сообщений о медицинских случаях указывают на то, что кетогенная диета может уменьшить воспаление и улучшить качество жизни при СРК и ВЗК.
Я хочу подчеркнуть, что я не верю, что кетогенная диета подходит для всех. Мое намерение этой статьей не состояло в том, чтобы предложить всем с кишечным расстройством попробовать кетогенную диету. Я просто хотела прояснить большую путаницу и дать более полное обсуждение доказательств для диет с высоким содержанием жиров в отношении здоровья кишечника.
Есть также правильные и неправильные способы следовать кетогенной диете, когда дело доходит до здоровья кишечника. Кетогенная диета с высоким содержанием рафинированных растительных масел и обработанного мяса не даст такой же терапевтической пользы для кишечника, как диета, включающая полезные жиры, пастбищное мясо и множество не крахмалистых овощей.
Вот мои лучшие семь советов, как правильно поступать с желудком при употреблении жирной или кетогенной диеты:
1) Сосредоточьтесь на высококачественных жирах. Я говорю об авокадо, масле авокадо, оливковом масле, жирной рыбе, кокосовом масле, пастообразном топленом масле, масле, сале и т. Д. Попробуйте получить смесь мононенасыщенных, полиненасыщенных и насыщенных жиров. ** Избегайте высоко обработанных и рафинированных масел, таких как рапсовое, кукурузное и соевое масло. ** Если вы планируете длительное время придерживаться кетогенной диеты, я рекомендую получить полный профиль сердечно-сосудистой системы после того, как вы были на диете в течение 1-2 месяцев. Небольшая группа людей («гипер-респонденты») будет иметь увеличение количества частиц ЛПНП и, возможно, потребуется изменить их потребление жира или рассмотреть вопрос о модифицированной кетогенной диете, чтобы убедиться, что они не увеличивают сердечно-сосудистый риск.
2) Ешьте свои (не крахмалистые) овощи! Тот факт, что вам не обязательно нужен бутират, не означает, что вы должны экономить на овощах. Старайтесь получать разнообразные как сырые, так и приготовленные овощи всех видов и цветов.
3) Побалуйте себя ягодами. Ягоды — отличный источник пребиотиков с низким содержанием углеводов для поддержки роста полезных микробов.
4) Пейте кофе и какао. Полифенолы способствуют росту полезных микробов, поэтому употребляйте кофе и какао так, как это допустимо. Те, у кого сильная кишечная проницаемость или аутоиммунность, могут сначала захотеть избегать этих продуктов.
5) Учитывайте плотность питательных веществ и ешьте разные части животного от носа до хвоста. Размышляя о здоровье нашего кишечника и нашего тела в целом, мы всегда должны быть уверены, что потребляем высоко-питательные продукты, такие как моллюски и мясо органов. Также важно сбалансировать богатое метионином мышечное мясо с богатыми глицином частями животного, такими как хрящи, кожа и кости. Один из лучших способов сделать это — регулярно употреблять костный бульон.
6) Эксперимент! Лучший способ узнать, полезен ли кето для кишечника — попробовать это питание в течение 3-4 недель и посмотреть, как вы себя чувствуете. Обратите особое внимание на уровень вашей энергии, состояние кожи, настроение, продуктивность и пищеварение. Помните, что «здоровый» микробиом — это просто микробиом, который вы имеете, когда вы здоровы!
7) Попробуйте «кето-зону». Если вы не лечите хроническое заболевание с помощью терапевтического кетоза, нет необходимости находиться в кето до бесконечности. Поддерживая диапазон углеводов 20-120 грамм (в зависимости от уровня вашей активности), вы можете легко выскользнуть из кетоза, чтобы насладиться несколькими сладкими картофелями или бананами, а затем вернуться к кетозу на следующий день. Фактически, это может помочь вашему кишечнику и микробам поддерживать максимальную гибкость метаболизма.
На этом пока все! Обязательно сообщите мне, что вы думаете в комментариях ниже, и подпишитесь на мою рассылку, чтобы вы никогда не пропустили новый пост в блоге.
- Jiang, H. et al. Altered fecal microbiota composition in patients with major depressive disorder. Brain Behav. Immun. 48, 186–194 (2015).
- Johnson, K. V.-A. & Burnet, P. W. J. Microbiome: Should we diversify from diversity? Gut Microbes 7, 455–458 (2016).
- Schnorr, S. L. et al. Gut microbiome of the Hadza hunter-gatherers. Nature Communications 5, 3654 (2014).
- Role of microorganisms in the evolution of animals and plants: the hologenome theory of evolution | FEMS Microbiology Reviews | Oxford Academic. Available at: https://academic.oup.com/femsre/article/32/5/723/2398937. (Accessed: 12th October 2018)
- Warden, C. H. & Fisler, J. S. Comparisons of Diets Used in Animal Models of High-Fat Feeding. Cell Metabolism 7, 277 (2008).
- Majority of studies of high-fat diets in mice inaccurately portrayed. Available at: http://secure.ucdmc.ucdavis.edu/welcome/features/20080702_diet_warden/index.html. (Accessed: 9th October 2018)
- Borghjid, S. & Feinman, R. D. Response of C57Bl/6 mice to a carbohydrate-free diet. Nutr Metab (Lond) 9, 69 (2012).
- Swidsinski, A. et al. Reduced Mass and Diversity of the Colonic Microbiome in Patients with Multiple Sclerosis and Their Improvement with Ketogenic Diet. Front Microbiol 8, 1141 (2017).
- Fasano, A. & Shea-Donohue, T. Mechanisms of Disease: the role of intestinal barrier function in the pathogenesis of gastrointestinal autoimmune diseases. Nature Reviews Gastroenterology & Hepatology 2, 416–422 (2005).
- Storoni, M. & Plant, G. T. The Therapeutic Potential of the Ketogenic Diet in Treating Progressive Multiple Sclerosis. Multiple Sclerosis International (2015). doi:10.1155/2015/681289
- Olson, C. A. et al. The Gut Microbiota Mediates the Anti-Seizure Effects of the Ketogenic Diet. Cell 173, 1728-1741.e13 (2018).
- David, L. A. et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 505, 559–563 (2014).
- Rahim, A. & Bin, M. B. H. Gut microbial metabolome: regulation of host metabolism by SCFAs. (2016).
- Le Poul, E. et al. Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation. J. Biol. Chem. 278, 25481–25489 (2003).
- Roediger, W. E. W., Moore, J. & Babidge, W. Colonic Sulfide in Pathogenesis and Treatment of Ulcerative Colitis. Dig Dis Sci 42, 1571–1579 (1997).
- Tóth, C., Dabóczi, A., Howard, M., Miller, N. J. & Clemens, Z. Crohn’s disease successfully treated with the paleolithic ketogenic diet. International Journal of Case Reports and Images (IJCRI) 7, 570–578 (2016).
- Lowery, R. P., Wilson, J. M., Sharp, M. H., Wilson, G. J. & Wagner, R. The effects of exogenous ketones on biomarkers of CrohnâÂÂs disease: A case report. Journal of Gastroenterology and Digestive Diseases 2, (2017).
- Austin, G. L. et al. A Very Low-Carbohydrate Diet Improves Symptoms and Quality of Life in Diarrhea-Predominant Irritable Bowel Syndrome. Clinical Gastroenterology and Hepatology 7, 706-708.e1 (2009).
- Ghoshal, S., Witta, J., Zhong, J., de Villiers, W. & Eckhardt, E. Chylomicrons promote intestinal absorption of lipopolysaccharides. Journal of Lipid Research 50, 90–97 (2009).
- Erridge, C., Attina, T., Spickett, C. M. & Webb, D. J. A high-fat meal induces low-grade endotoxemia: evidence of a novel mechanism of postprandial inflammation. Am. J. Clin. Nutr. 86, 1286–1292 (2007).
- Laugerette, F. et al. Emulsified lipids increase endotoxemia: possible role in early postprandial low-grade inflammation. J. Nutr. Biochem. 22, 53–59 (2011).
- Harris, H. W. et al. Chylomicrons alter the fate of endotoxin, decreasing tumor necrosis factor release and preventing death. J. Clin. Invest. 91, 1028–1034 (1993).
- Manco, M., Putignani, L. & Bottazzo, G. F. Gut microbiota, lipopolysaccharides, and innate immunity in the pathogenesis of obesity and cardiovascular risk. Endocr. Rev. 31, 817–844 (2010).
- Vreugdenhil, A. C. E. et al. Lipopolysaccharide (LPS)-binding protein mediates LPS detoxification by chylomicrons. J. Immunol. 170, 1399–1405 (2003).
- Parlesak, A., Schaeckeler, S., Moser, L. & Bode, C. Conjugated primary bile salts reduce permeability of endotoxin through intestinal epithelial cells and synergize with phosphatidylcholine in suppression of inflammatory cytokine production. Crit. Care Med. 35, 2367–2374 (2007).
- Pinto, A., Bonucci, A., Maggi, E., Corsi, M. & Businaro, R. Anti-Oxidant and Anti-Inflammatory Activity of Ketogenic Diet: New Perspectives for Neuroprotection in Alzheimer’s Disease. Antioxidants (Basel) 7, (2018).
- Keating, N. & Keely, S. J. Bile acids in regulation of intestinal physiology. Curr Gastroenterol Rep 11, 375–382 (2009).
- Lorenzo‐Zúñiga, V. et al. Oral bile acids reduce bacterial overgrowth, bacterial translocation, and endotoxemia in cirrhotic rats. Hepatology 37, 551–557 (2003).
- Kidd, M. et al. Luminal regulation of normal and neoplastic human EC cell serotonin release is mediated by bile salts, amines, tastants, and olfactants. Am. J. Physiol. Gastrointest. Liver Physiol. 295, G260-272 (2008).
![]()

