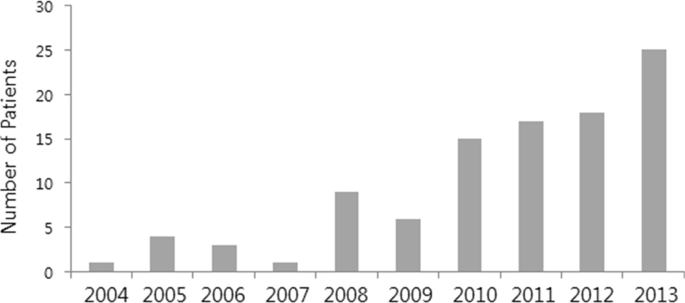
https://www.nature.com/articles/s41598-019-45147-6?fbclid=IwAR1Z3kIsAjhe3G6sjdgI-WPf-Hlc-hb4-lxLuBdNIUunbBJdhsAomwjPSZc
.
Кетогенная диета у детей от 3 лет и младше: 10-летний опыт работы в одном центре
.
The ketogenic diet in children 3 years of age or younger: a 10-year single-center experience
Scientific Reportsvolume 9, Article number: 8736 (2019)
Аннотация:
Кетогенная диета (КД) является эффективным вариантом лечения трудноизлечимой эпилепсии. Здесь мы рассмотрели последние 10 лет нашего опыта с КД и охарактеризовали его применение у пациентов в возрасте до 3 лет. Медицинские карты всех пациентов в возрасте до 3 лет, которые получали кетогенную диету с апреля 2004 года по июнь 2014 года, были проанализированы ретроспективно. Сто девять пациентов с лекарственно-устойчивой эпилепсией были включены. Средний возраст начала KD составлял 1,4 ± 0,8 года. Самому младшему пациенту было 3 недели. Через 3 месяца 39% (42/109) пациентов продемонстрировали реакцию на КД и испытали снижение судорог более чем на 50%. Из этих 42 пациентов 20 (18%) достигли полного контроля над приступами. Пациенты с генетической этиологией показали лучшую реакцию на КД при снижении судорог, чем другие пациенты (р = 0,03). Возраст начала КД не был связан с возможным исходом контроля судорог (р = 0,6). KD продолжает оставаться эффективным, безопасным и хорошо переносимым вариантом лечения для младенцев с трудноизлечимой эпилепсией.
Вступление:
Кетогенная диета (KD) — это диета с высоким содержанием жиров, низким содержанием углеводов и белков, которая строго контролируется с медицинской точки зрения и широко признана в качестве эффективного варианта лечения трудноизлечимой эпилепсии. Начало использования этой диеты в Соединенных Штатах относится к 1920-м годам, когда Вудьятт и Уайлдер независимо друг от друга описали производство бета-гидрокси-масляной кислоты в организме или кетонемию с помощью диетических манипуляций, отличных от голодания 1,2.
В рандомизированном контролируемом исследовании, в котором были проанализированы 103 ребенка разного возраста, типов приступов и синдромов эпилепсии, у 38% детей, получавших КД через 3 месяца было снижение судорог более чем на 50% по сравнению с 6% в контрольной группе детей, использующих гетерогенные противосудорожные терапии. 7% в группе диеты имели снижение судорог более чем на 90% по сравнению с контрольной группой 3. В целом, хотя использование КД в качестве терапии инфантильных спазмов (IS) является, пожалуй, наиболее известным и исследованным методом 4,5,6,7, его эффективность, безопасность и переносимость для малоподвижной эпилепсии с детским началом независимо от типа приступа начали разрабатываться 7,8,9. Недавний опрос медицинских работников по использованию кетогенной диеты обновил давно укоренившееся представление о том, что это была терапия «последней инстанции». В рамках подтипов детской эпилепсии начало считалось первым или вторым лечением переносчика глюкозы. дефицит белка 1 (GLUT1) (86%) и третий или четвертый для синдромов Драве (63%) и Веста (71%) 10. Несмотря на это, различные аспекты применения и полезности КД у младенцев остаются менее понятными, в том числе: предикторы благоприятного ответа, комбинированное использование экстрагированного грудного молока, потенциальные нежелательные явления, причины раннего отказа от приема пищи, а также эффективность диеты в управление специфическими синдромами и этиологиями эпилепсии. Как успехи в области медицинской геномики и растущая идентификация мутаций причинных генов при эпилепсии могут в конечном итоге применяться к кетогенной диете, представляет значительный интерес.
Кетогенная диета продолжает использоваться в Детской Мемориальной Больнице (переименованной в Детскую Больницу Энн и Роберта Х. Лурье в Чикаго) с 1963 года11. В этом исследовании мы ретроспективно рассмотрели последние 10 лет нашего опыта с КД и охарактеризовали его использование в пациенты в возрасте до 3 лет. Наши цели состояли в том, чтобы (1) определить предикторы благоприятного исхода, (2) исследовать причины преждевременной отмены в связи с возрастом, составом рациона питания или неблагоприятными событиями, и (3) оценить эффективность с особым учетом синдрома эпилепсии или этиологии, используя генетические диагнозы, если таковые имеются.
Meтоды
Информация о демографии пациентов, типах приступов, частоте приступов, синдроме эпилепсии, этиологии, результатах МРТ и результатах электроэнцефалограммы была ретроспективно извлечена из медицинских карт всех пациентов в возрасте до 3 лет, которые получали кетогенную диету с апреля 2004 г. по июнь 2014 г. в детской Lurie (бывшая детская мемориальная больница). У всех пациентов была неразрешимая с медицинской точки зрения эпилепсия, определяемая как постоянные судороги, несмотря на использование двух или более подходящих противосудорожных препаратов в терапевтических дозах.
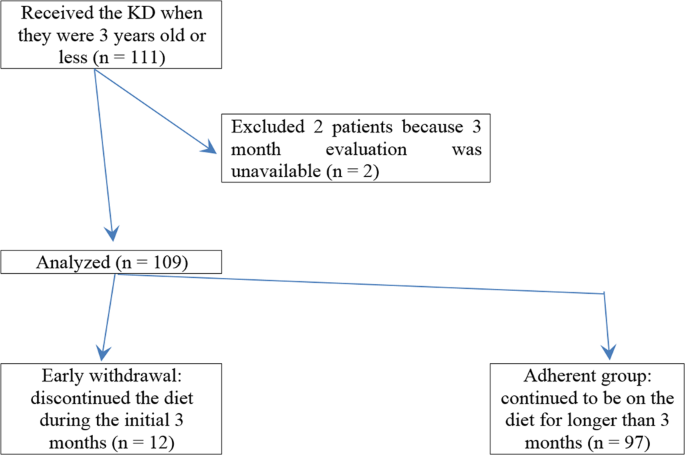
Ранний уход от диеты и ранняя отмена КД были определены как прекращение КД до того, как прошло 3 месяца лечения. В нашем анализе мы рассмотрели раннее прекращение, раннее прекращение и общее несоблюдение. Затем пациенты были разделены на две группы: (1) группа ранней отмены и (2) группа приверженцев (рис. 1). Чтобы определить причины ранней отмены, были рассмотрены три клинические особенности: очень кратковременная эффективность КД, нежелательные явления, а также внедрение и практика КД. Было подсчитано количество пациентов, которые рано вышли из рациона из-за неэффективности.
Кроме того, пациенты, которые провели 3 месяца на КД, были разделены на четыре группы на основе процента снижения судорог за 3 месяца: (1) полный контроль судорог, (2) улучшение> 90%, (3) улучшение 50–90% и (4) улучшение <50%. Респонденты были определены как те, кто испытал>50% снижение судорог. Лица, не отвечающие на лечение, были определены как те, у кого было <50% снижение судорог. Частота судорог сообщалась родителями, а также ЭЭГ, когда они были доступны. Мы определили побочные эффекты в целом, включая как новую клиническую симптоматику, так и лабораторные аномалии, которые начались при использовании КД. События, которые побудили досрочное снятие с диеты были также указаны. Чтобы оценить практические детали внедрения и ведения KD, мы оценили соотношение (граммы жира к грамму углевод + белок), метод потребления пищи и тип потребляемой пищи. Наконец, чтобы выяснить какие-либо возрастные результаты, пациенты были далее разделены на три группы в зависимости от их возраста в начале КД и оценены следующим образом: (1) пациенты <1 года, (2) 1-2 года, и (3)>2 года. Исследование было одобрено Институциональным наблюдательным советом детской больницы Лурье. Все исследования проводились в соответствии с соответствующими руководящими принципами/правилами, и для этого ретроспективного исследования был предоставлен отказ от информированного согласия.
Протокол КД
До начала КД междисциплинарная оценка проводилась двумя зарегистрированными диетологами, медсестрами высокой квалификации и лицензированным клиническим социальным работником. Во время визита был получен обзор истории болезни, обсуждены протоколы питания и последствия для образа жизни, а также проведено неврологическое обследование. После этого предварительного визита была выбрана одна из следующих комбинаций механизма потребления пищи и типа пищи: пероральная жидкость, жидкость для кормления через трубку, пероральные твердые пищевые продукты или комбинация пероральной жидкости и твердой пищи. Жидкие продукты включают: индивидуально приготовленные блюда с маслами, а также коммерческие составы, в том числе KetoCal® (Nutricia Inc., Gaithersburg, MD, USA) и на основе соевого состава Ross Carbohydrate Free® с железом (Abbott Nutrition, Columbus, OH, USA). Индивидуальная калорийность и количества белка были рассчитаны нашими диетологами на основе стандартных ежедневных потребностей в зависимости от возраста, исходного веса и роста, уровня активности и оценки потребления перед диетой. Добавки с витаминами и минералами обеспечивались в зависимости от потребностей отдельных пациентов и используемых видов пищи. KD был начат в соотношении 1:1 (грамм жира: углеводы + грамм белка) без голодания в стационаре. Коэффициент кетогенности увеличивался ежедневно, достигая 3:1 на 3-й день. На 4-й день пациенты выписывались домой с соотношением 3:1 с полной калорийностью рациона. Жидкости не были ограничены. Пациенты затем обследовались нашей междисциплинарной командой KD через 1 месяц, а затем каждые 3 месяца. Проводились периодические амбулаторные корректировки соотношения рациона питания, количества калорий и количества белка для максимального контроля судорог, минимизации побочных эффектов и поддержания соответствующего роста.
Статистический анализ
Чтобы определить факторы, которые были связаны с ранней отменой КД, мы сравнили клинические переменные между группой ранней отмены и продолжающейся (следующей КД) группой. Мы использовали независимый t-тест или U-критерий Манна-Уитни для анализа непрерывных переменных, включая возраст начала KD, возраст начала приступа, начало приступа до начала KD, длительность KD и количество предшествующих противоэпилептических препаратов. Для категориальных данных использовался критерий хи-квадрат Пирсона для независимости строк и столбцов. Значения p <0,05 считались статистически значимыми. Статистический анализ проводили с использованием SPSS версии 22 (SPSS Inc., Чикаго, Иллинойс, США). Данные выражены в виде числа (%), среднего значения ± стандартное отклонение или медиана (межквартильный диапазон (IQR)).
Результаты
Базовые характеристики
Сто одиннадцати пациентам в возрасте до 3 лет была введенана КД (рис. 1). Два пациента были исключены из исследования: одному пациенту была сделана операция по лечению эпилепсии после одного месяца лечения с KD; другой, пациент с ранней миоклонической энцефалопатией (EME), умер из-за дыхательной недостаточности через 2 месяца после начала лечения KD. В итоге к анализу были привлечены сто девять пациентов с лекарственно-устойчивой эпилепсией (рис. 2). Подробная информация о базовых характеристиках пациентов приведена в таблице 1. Средний возраст начала приступа составлял 4 (IQR 1–6) месяца. Среднее количество ранее предпринятых и / или одновременно применяемых лекарств во время начала КД составляло 4 (IQR 3–5). Примерно у половины (56%) пациентов был синдром Веста. ЭЭГ была ненормальной у всех пациентов в начале диеты.
Средний возраст начала KD составлял 1,4 ± 0,8 года. Самому младшему пациенту было 3 недели. Среди 105 пациентов, относительно которых была доступна информация о соотношении KD, 20 были в соотношении 3:1, 13 были в соотношении 3,5:1 и 59 в 4:1. В целом, 12 были в соотношении выше, чем 4:1. Максимальное используемое соотношение составляло 4,75:1. Каждый ребенок достигал соотношения жира и обезжиренного жира 3:1 или выше, за исключением одного ребенка, который был в соотношении 2,75:1. Форма пищи, которая использовалась, включала твердую пищу (33%, 35/104), жидкую пищу (32%, 34/104) и их комбинацию (33%, 35/104). [Среди 69 пациентов, которые получали жидкую форму KD, 96% (66/69) использовали кетогенную формулу, в то время как 4% (3/69) вводили в индивидуально разработанную жидкую смесь. Восемь пациентов использовали сцеженное грудное молоко. Средняя продолжительность КД составила 1,1 (IQR 0,5–2,2) года. Все, кроме одного пациента, имели положительный анализ на кетоны в моче в какой-то момент во время диеты. В одном нетипичном случае уровень B-гидроксибутирата в сыворотке крови составлял 1,32 ммоль / л, и судороги не реагировали (снижение судорог <50%) за 3 месяца диетотерапии.
Эффективность
Через 3 месяца 39% (42/109) пациентов ответили на КД и продемонстрировали снижение судорог более чем на 50%. Из этих 42 пациентов 20 (18%) достигли полного контроля над приступами, а еще у 3 (3%) наблюдалось снижение судорог на> 90% (Таблица 1). Не было существенной разницы между возрастом в начале приступа (р = 0,2) и возрастом в начале KD (р = 0,5) между респондентами и нереспондентами. Количество ранее или в настоящее время используемых противосудорожных препаратов было ниже среди респондеров (р = 0,02).
Возможно, из-за небольшого числа пациентов, никакая специфическая этиология не была в значительной степени связана с положительным ответом на КД (Таблица 2). Интересно, однако, что пациенты с подтвержденной генетической мутацией или хромосомной аномалией показали лучшую реакцию на KD при уменьшении судорог, чем другие пациенты (p = 0,03). Генетические аномалии были выявлены у 29 пациентов и включали мутации следующих генов: BRAF, CDG 1p, CDKL5, SCN1A, SCN2A, SCN8A, KCNQ2, DCX, EEF1A2, GFAP, GRIN2A, MTO, POLG, RARS2, TSC2, SLC35A8 и SLC6A2. Трисомия 21 была обнаружена у 5 пациентов. Микроделеции хромосомы 1, 6 и 16 были обнаружены у 5 пациентов. KD был одинаково эффективен у пациентов с различными ранними эпилепсиями и у пациентов с синдромом Веста.
В целом, не было ни одного нарушения ЭЭГ, которое независимо было бы связано с благоприятным ответом на КД. У пациентов с очаговым замедлением и резкими изменениями базовой ЭЭГ наличие электрокрементов свидетельствовало о плохой реакции, но не показало значимой разницы (р = 0,09).
Раннее прекращение и связанные с этим факторы
Только 12 из 109 пациентов (11%) отказались от диеты до срока 3 месяца. Наиболее частой причиной отказа было родительское недовольство жесткостью диеты (7/12). Только пять пациентов прекратили диету рано из-за ощущаемой неэффективности (3/12) или из-за неблагоприятного события (2/12) (Таблица 3). Молодые пациенты, которым давали кетогенную смесь с твердо пищей или без, с большей вероятностью продолжали диету (р = 0,003). Высокое отношение KD (≥4:1), использование трубки для кормления или использование сцеженного грудного молока не были связаны с ранним прекрсащением KD. Молодые пациенты, которым давали кетогенную формулу, с большей вероятностью продолжали диету (р = 0,003).
Молодые пациенты, которым давали кетогенную формулу, с большей вероятностью продолжали диету (р = 0,003). Высокое отношение KD (≥4:1), использование трубки для кормления или использование сцеженного грудного молока не были связаны с ранним сходом с KD.
Двумя нежелательными явлениями, которые вызывали раннюю отмену, были поведенческий отказ от пищи и постоянный ацидоз в условиях недостаточного потребления пищи. Ни одно конкретное неблагоприятное событие не происходило чаще среди ранних сходов с КД. О запорах чаще сообщалось в группе тех, которые находились на диете в течение более длительного периода времени (р = 0,009). Более подробная информация о побочных эффектах представлена в таблице 4.
Влияние возраста
Возраст начала КД не был связан с возможным контролем приступов (р = 0,6). Кроме того, возраст не был связан с ранним выходом из КД (р = 0,2). Интересно, однако, что возрастная группа, которая с наибольшей вероятностью ранего выхода из КД, была группа 2 (пациенты от 1 до 2 лет) (7/12, 58%). Эта группа также показала более широкое разнообразие типов пищи, используемых во время КД, по сравнению с двумя другими группами, чьи варианты пищи были более избирательными. Как и следовало ожидать, формула использовалась чаще у младших пациентов (<1 года). У более взрослых пациентов (> 2 лет) преобладали твердые продукты. У пациентов в возрасте от 1 до 2 лет не было обнаружено единственного преобладающего типа пищи (р <0,0001). Детали приведены в Таблице 5. Общее количество нежелательных явлений не было связано с возрастом (р = 0,6). Пациенты, которые начали KD раньше (до 2 лет), однако, с большей вероятностью сообщали о запоре (р = 0,005). Камни в почках наблюдались только у пациентов моложе 1 года, но разница по возрасту не была статистически значимой (р = 0,07). Пациенты, которые прекратили KD рано из-за неблагоприятного события, были 1,9 и 2,6 года на момент начала KD.
Обсуждение
В течение 10 лет в нашем центре более 100 пациентам была введена КД до того, как им исполнилось 3 года. В целом, 20% пациентов стали свободными от приступов, и многие (39%) испытали значительное снижение судорог (>50%) после первых 3 месяцев терапии KD. Эта тенденция аналогична той, что сообщали другие исследования для детей более старшего возраста, в которых у 27–38% детей снижение судорожности составило>50% через 3 месяца3,12. Результаты также были сопоставимы с показателями снижения судорог у детей с синдромом Веста, которые варьировались от 39% до 67% 4,6,13.
Наше предыдущее исследование было первым, чтобы исследовать роль KD у детей с эпилепсией, отличной от синдрома Веста / инфантильных спазмов7. Пятнадцать лет назад у нас была только ограниченная способность оценивать эффективность КД с этиологической специфичностью. С тех пор были проведены небольшие исследования и серии случаев или сообщений о случаях, рассматривающих роль диеты в отдельных синдромах эпилепсии или заболеваниях, которые могут включать инфантильные проявления, такие как: синдром дефицита GLUT-1, дефицит пируватдегидрогеназы (PDHD), тяжелая миоклоническая болезнь. эпилепсия младенчества (синдром Драве), синдром Ретта и отдельные митохондриальные расстройства 14,15,16,17. Однако ни одно из этих исследований не было сосредоточено исключительно на раннем введении КД в течение периода времени от 3 лет и младше. Было бы очень полезно определить, какие синдромы эпилепсии, кроме синдрома Веста, и какие этиологии более чувствительны к КД, чтобы способствовать раннему обращению и началу лечения. В настоящем исследовании не было значительных различий между эффективностью КД для пациентов с синдромом Веста и другими синдромами эпилепсии, что говорит о том, что следует рано рассматривать применение КД у всех детей с рефрактерной эпилепсией после исключения противопоказаний.
Более того, по нашему опыту, подтвержденная генетическая аномалия была предиктором хорошего ответа на КД. Почти у половины пациентов с подтвержденной генетической аномалией наблюдалось снижение частоты приступов>50%. Аналогичное открытие было описано в ретроспективном обзоре карт 64 пациентов с рефрактерной эпилепсией, детей и взрослых, которые начали лечение КД в центре третичной эпилепсии18. Этот вывод подразумевает, что врачи могут также рассмотреть вопрос о КД раньше, возможно, даже до того, как пациент продемонстрирует предварительно то, что не подходят два предыдущих противосудорожных препарата, если он или она получит положительный генетический диагноз. Кроме того, раннее начало диеты не только дает выгоду из-за простоты использования и переносимости, связанной с возрастом, но также может заинтересовать родителей, обеспокоенных потенциальными противосудорожными побочными эффектами, о чем свидетельствуют результаты других исследований 8,19.
По нашему опыту с 109 детьми в возрасте до 3 лет, КД была безопасно введена и переносилась в течение первых 3 месяцев. Только около 10% детей сошли рано сдиеты. Среди них мы не обнаружили критических побочных эффектов, связанных с использованием КД. Уровень преждевременной отмены был сопоставим с таковым у детей старшего возраста, который варьировался от 12% до 16% 3,12,20. В исследовании со взрослыми было зарегистрировано гораздо большее количество ранних шодов с диеты. Внедрение и поддержание KD было легче у маленьких детей, у которых диета все еще остается гибкой, что подтверждается данными предыдущих исследований с меньшими размерами выборки, в которых были обнаружены такие же низкие показатели раннего вывода КД детям из этой возрастной группы (<2 лет) 4,5,7,13.
Учитывая, что это исследование проводилось в центре третичной детской эпилепсии со специализированной командой KD, было удивительно обнаружить, что неудовлетворенность родителей диетой была наиболее частой причиной преждевременной отмены КД. Это открытие подчеркивает обширную междисциплинарную поддержку, в которой нуждаются родители при использовании диеты, особенно в сложный период введения твердой пищи.
Неблагоприятные события были редкой причиной преждевременной отмены КД у детей (2%), хотя многие дети испытывали, по крайней мере, один такой эпизод во время их 3-месячного следования KD (63%, 69/109). Этот вывод частично согласуется с предыдущими сообщениями, в которых описывалось, что примерно 30% детей испытывают нежелательные явления, но только 3–5% детей прекращают диету из-за нежелательных явлений4,5. Мы подозреваем, что сообщаемая частота нежелательных явлений была выше в нашем исследовании, потому что наш предопределенный порог для сообщения о нежелательных явлениях был намеренно установлен низким. Например, такие слабые симптомы, как трудности с кормлением или самоограничение, небольшая рвота были включены в качестве нежелательных явлений, которые, в свою очередь, были связаны с брезгливостью родительской реакции или клинического суждения соответствующего медицинского работника. Кроме того, лабораторные нарушения, такие как снижение уровня бикарбоната или глюкозы, которые были описаны в других исследованиях, но не были зарегистрированы как побочные эффекты, были учтены как таковые в наших исследованиях. Мы считаем, что полнота наших отчетов поможет руководству врачей и лиц, обеспечивающих уход, когда они планируют начать диету у младенцев и детей младшего возраста.
Существовала значительная связь между ранним отказом от диеты и типом пищи, которая использовалась. В то время как в нескольких сериях случаев и в коротких исследованиях предлагалось улучшить переносимость жидкого варианта KD4,21,22,23, его применение никогда не изучалось исключительно у детей, в группе, которая не только чаще всего использует этот состав, но кто также может извлечь наибольшую пользу из этого. Наше исследование показывает, что жидкий вариант КД с кетогенной смесью можно безопасно и эффективно использовать у детей грудного возраста и что он может даже улучшить соблюдение диеты пациентами и родителями. Мы также сообщаем здесь о восьми детях, которые успешно завершили диету комбинацией формулы и сцеженного грудного молока. Использование грудного молока не было связано ни с ранней отменой, ни с плохим исходом с точки зрения контроля судорог. Этот вывод свидетельствует о том, что рассмотрение кетогенной диетотерапии не должно сразу вызывать раннее отлучение от грудного молока.
Мы не обнаружили каких-либо возрастных различий в отношении результатов или практики терапии КД у маленьких детей. Некоторые исследования предположили, что молодой возраст во время КД был благоприятным фактором, в то время как другие сделали 7,20,24. В нашем исследовании возраст был связан не с исходом судорог, а с методами КД и побочными эффектами. Младшие (<1 года) с большей вероятностью питались жидкой пищей KD, в то время как старшие (> 2 года) питались твердой пищей. Младшие были более склонны испытывать запоры и низкие уровни карнитина по сравнению со старшими. Кроме того, хотя мы не увидели статистически значимой разницы, мы также увидели возрастную тенденцию в отношении раннего схода с диеты. Интересно, что не дети старшего возраста (> 2 лет) или младшие (<1 года), а дети, начавшие КД в возрасте от 1 до 2 лет, как правило, чаще отказывались от диеты раньше, чем дети двух других групп (р = 0,15). Мы предполагаем, что применение КД может быть более сложным для детей в период, когда им впервые вводят твердую пищу. В этот период родителям может быть сложнее ограничить диету или измерить ее количество. Наши данные, касающиеся выбранных вариантов питания, подтверждают этот вывод, согласно которому было зарегистрировано большее различие среди детей в возрасте от 1 до 2 лет по сравнению с двумя другими возрастными группами, в которых преимущественно использовался один тип пищи (твердое и жидкое) ( р = 0,001).
Данные о росте пациентов не были включены. В некоторых исследованиях сообщалось об остеопении, задержке роста и потере веса у детей на KD25,26. Было бы полезно узнать, как решать эти проблемы более целенаправленно в период младенчества, однако, они могут быть более правильно рассмотрены в долгосрочной оценке в сотрудничестве с эндокринологом. В настоящее время роль кетоза во время диеты остается неизвестной. В нашем исследовании потенциальные отношения между кетозом и частотой приступов или абстинентного синдрома не оценивались. Техническое ограничение: кетоны мочи положительны для большинства пациентов. Кроме того, из-за ретроспективного характера исследования было трудно определить временную связь между кетонами в моче и уменьшением судорог. Недавнее исследование продемонстрировало противоречивую взаимосвязь между кетозом и хорошим контролем судорог у детей 12,13. Верность этих отношений может быть рассмотрена в будущем исследовании. Наконец, контекст, в котором было завершено это исследование — комплексный центр эпилепсии с двумя диетологами, работающими исключительно на КД, — возможно, снизил уровень преждевременной отмены. С другой стороны, из-за большого количества направлений для лечения трудноизлечимой эпилепсии мы, возможно, выборочно включили детей с наиболее тяжелыми формами эпилепсии. Несмотря на эти ограничения, исследование имеет клиническое значение.
Заключение
KD продолжает оставаться эффективным, безопасным и хорошо переносимым вариантом лечения для младенцев с трудноизлечимой эпилепсией. В этой возрастной группе переносимость может быть повышена путем использования жидкой диеты, роль сцеженного грудного молока должна быть уточнена. Доступность новых диагностических исследований, таких как генетическое тестирование, может способствовать раннему и эффективному использованию KD путем выявления пациентов, которые могут благоприятно реагировать на KD. Будущие исследования с большим размером выборки пациентов требуют многоцентрового сотрудничества и позволят еще больше улучшить понимание того, какие генетические аномалии и синдромы эпилепсии лучше всего отвечают на кетогенную диету.
Доступность данных
Наборы данных, сгенерированные во время и / или проанализированные в ходе текущего исследования, можно получить у соответствующего автора по обоснованному запросу.
Дополнительная информация
Publisher’s note: Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Ссылки:
1.
Вудьятт, Р. Т. Объекты и методика корректировки диеты при диабете. Архивы внутренней медицины 28, 125–141 (1921).
CAS
Статья
Google ученый
2.
РМ В. Влияние кетонемии на течение эпилепсии. Mayo Clin Bull 2, 307–308 (1921).
Google ученый
3.
Нил, Э. Г. и соавт. Рандомизированное исследование классических и среднецепочечных триглицеридных кетогенных диет при лечении детской эпилепсии. Эпилепсия 50, 1109–1117 (2009).
Статья
Google ученый
4.
Eun, S.H., Kang, H.C., Kim, D.W. & Kim, H.D. Кетогенная диета для лечения инфантильных спазмов. Brain & Development 28, 566–571 (2006).
Статья
Google ученый
5.
Hong, A.M., Turner, Z., Hamdy, R.F. & Kossoff, E.H. Инфантильные спазмы, леченные кетогенной диетой: предполагаемый одноцентровый опыт у 104 последовательных детей. Эпилепсия 51, 1403–1407 (2010).
Статья
Google ученый
6.
Коссофф, Э. Х., Пизик, П. Л., МакГроган, Дж. Р., Вининг, Э. П., Фриман, Дж. М. Эффективность кетогенной диеты при инфантильных спазмах. Педиатрия 109, 780–783 (2002).
Статья
Google ученый
7.
Nordli, D.R. Jr. et al. Опыт применения кетогенной диеты у детей грудного возраста. Педиатрия 108, 129–133 (2001).
Статья
Google ученый
8.
Dressler, A. et al. Кетогенная диета у детей грудного возраста — Преимущества раннего использования. Исследования эпилепсии 116, 53–58 (2015).
Статья
Google ученый
9.
Коссофф, Э. Х. и соавт. Оптимальное клиническое ведение детей, получающих диетическую терапию при эпилепсии: обновленные рекомендации Международной группы по изучению кетогенной диеты. Epilepsia Open 3, 175–192 (2018).
Статья
Google ученый
10.
Юнг, Д. Э., Джоши, С. М. и Берг, А. Т. Как ты кето? Обследование педиатрических кетогенных центров диеты Северной Америки. Журнал детской неврологии 30, 868–873 (2015).
Статья
Google ученый
References
- 1.
Woodyatt, R. T. Objects and method of diet adjustment in diabetes. Archives of Internal Medicine 28, 125–141 (1921).
- 2.
RM W. The effects of ketonemia on the course of epilepsy. Mayo Clin Bull 2, 307–308 (1921).
- 3.
Neal, E. G. et al. A randomized trial of classical and medium-chain triglyceride ketogenic diets in the treatment of childhood epilepsy. Epilepsia 50, 1109–1117 (2009).
- 4.
Eun, S. H., Kang, H. C., Kim, D. W. & Kim, H. D. Ketogenic diet for treatment of infantile spasms. Brain & Development 28, 566–571 (2006).
- 5.
Hong, A. M., Turner, Z., Hamdy, R. F. & Kossoff, E. H. Infantile spasms treated with the ketogenic diet: prospective single-center experience in 104 consecutive infants. Epilepsia 51, 1403–1407 (2010).
- 6.
Kossoff, E. H., Pyzik, P. L., McGrogan, J. R., Vining, E. P. G. & Freeman, J. M. Efficacy of the ketogenic diet for infantile spasms. Pediatrics 109, 780–783 (2002).
- 7.
Nordli, D. R. Jr. et al. Experience with the ketogenic diet in infants. Pediatrics 108, 129–133 (2001).
- 8.
Dressler, A. et al. The ketogenic diet in infants–Advantages of early use. Epilepsy Research 116, 53–58 (2015).
- 9.
Kossoff, E. H. et al. Optimal clinical management of children receiving dietary therapies for epilepsy: Updated recommendations of the International Ketogenic Diet Study Group. Epilepsia Open 3, 175–192 (2018).
- 10.
Jung, D. E., Joshi, S. M. & Berg, A. T. How do you keto? Survey of North American pediatric ketogenic diet centers. Journal of Child Neurology 30, 868–873 (2015).
- 11.
Millichap, J. G., Jones, J. D. & Rudis, B. P. Mechanism of anticonvulsant action of ketogenic diet. Studies in animals with experimental seizures and in children with petit mal epilepsy. American Journal of Diseases of Children 107, 593–604 (1964).
- 12.
Neal, E. G. et al. The ketogenic diet for the treatment of childhood epilepsy: a randomised controlled trial. Lancet Neurology 7, 500–506 (2008).
- 13.
Numis, A. L., Yellen, M. B., Chu-Shore, C. J., Pfeifer, H. H. & Thiele, E. A. The relationship of ketosis and growth to the efficacy of the ketogenic diet in infantile spasms. Epilepsy Research 96, 172–175 (2011).
- 14.
Gano, L. B., Patel, M. & Rho, J. M. Ketogenic diets, mitochondria, and neurological diseases. Journal of Lipid Research 55, 2211–2228 (2014).
- 15.
Liebhaber, G. M., Riemann, E. & Baumeister, F. A. M. Ketogenic diet in Rett syndrome. Journal of Child Neurology 18, 74–75 (2003).
- 16.
Ramm-Pettersen, A. et al. Good outcome in patients with early dietary treatment of GLUT-1 deficiency syndrome: results from a retrospective Norwegian study. Developmental Medicine and Child Neurology 55, 440–447 (2013).
- 17.
Sofou, K. et al. Ketogenic diet in pyruvate dehydrogenase complex deficiency: short- and long-term outcomes. Journal of Inherited Metabolic Disease 40, 237–245 (2017).
- 18.
Thammongkol, S. et al. Efficacy of the ketogenic diet: which epilepsies respond? Epilepsia 53, e55–e59 (2012).
- 19.
Rubenstein, J. E. et al. Experience in the use of the ketogenic diet as early therapy. Journal of Child Neurology 20, 31–34 (2005).
- 20.
Vining, E. P. et al. A multicenter study of the efficacy of the ketogenic diet. Archives of Neurology 55, 1433–1437 (1998).
- 21.
Kang, H. C., Kim, H. D. & Kim, D. W. Short-term trial of a liquid ketogenic milk to infants with West syndrome. Brain & Development 28, 67 (2006).
- 22.
Kossoff, E. H., Dorward, J. L., Turner, Z. & Pyzik, P. L. Prospective study of the modified atkins diet in combination with a ketogenic liquid supplement during the initial month. Journal of Child Neurology 26, 147–151 (2011).
- 23.
Kossoff, E. H., McGrogan, J. R. & Freeman, J. M. Benefits of an all-liquid ketogenic diet. Epilepsia 45, 1163 (2004).
- 24.
Suo, C. et al. Efficacy and safety of the ketogenic diet in Chinese children. Seizure 22, 174–178 (2013).
- 25.
Groleau, V., Schall, J. I., Stallings, V. A. & Bergqvist, C. A. Long-term impact of the ketogenic diet on growth and resting energy expenditure in children with intractable epilepsy. Dev Med Child Neurol 56, 898–904 (2014).
- 26.
Kang, H. C., Chung, D. E., Kim, D. W. & Kim, H. D. Early- and late-onset complications of the ketogenic diet for intractable epilepsy. Epilepsia 45, 1116–1123 (2004).
![]()