Is a high-fat or ketogenic diet bad for your gut?
.
LUCY MAILING, MD/PHD
.
.
This article was originally published in October 2018 and updated in June 2020 to include the latest research. The major conclusions from the original article have not changed, with the exception that those with hydrogen sulfide overgrowth should probably steer clear of keto.
.
На самом деле мы не знаем, что составляет «здоровый» микробиом
.
Новые технологии и растущий интерес к здоровью кишечника в последние годы резко расширили наше понимание кишечного микробиома, и коммерческие тесты на микробиом теперь позволяют любому человеку узнать о том микробиоме, который обитает в его кишечнике. К сожалению, ажиотаж опередил исследования, и правда состоит в том, что мы очень мало знаем о том, что представляет собой «здоровая» микробиота кишечника.
Микробиом кишечника эволюционировал вместе с нами — часто в контексте периодического кетоза.
Наши отношения с кишечными микробами сегодня являются результатом совместной эволюции тысяч поколений. В течение миллионов лет эволюция воздействовала не только на наши 23 000 человеческих генов, но и на почти 4 миллиона генов (как человеческих, так и микробных), которые присутствуют в наших телах и на них.4 Мы такие, какие мы есть сегодня, так как как мы развивались вместе с нашими микробами.
Окружающая среда, в которой мы развивались, требовала регулярной адаптации к меняющимся условиям. Наши предки не всегда имели постоянный доступ к пище, и время от времени голодали, когда еды не хватало. Таким образом, наши тела обладают способностью сжигать и использовать углеводы, когда пищи много, и превращать диетический жир или накопленный жир в кетоны для получения энергии, когда пищи или углеводов мало. Эта способность переключать наш метаболизм на изменения в потреблении пищи называется метаболической гибкостью.
Итак, реальный вопрос здесь: Почему наши тела должны обладать метаболической гибкостью, чтобы справляться с изменяющейся доступностью продуктов, а наш микробиом кишечника не обладает такой же метаболической гибкостью? Неужели наши предки действительно создавали «больной» микробиом каждый раз, когда крахмалистых углеводов становился дефицит? Думаю, что нет.
Давайте также рассмотрим традиционные культуры, такие как инуиты. Действительно ли у инуитов, которые ели очень мало растительной пищи, был нездоровый микробиом? Или у них был микробиом, который был уникально адаптирован к их рациону? Были ли у них ненормальная проницаемость кишечника и воспаление от их высокожировой диеты? Или их кишечник также обладал определенной метаболической гибкостью, которая позволяла им выживать, питаясь преимущественно животным белком и жиром.
Но хватит разговоров — давайте углубимся в данные.
Исследования на животных, которым дают «диету с высоким содержанием жиров», вводят в заблуждение
Если вы сделаете поиск в любой базе данных научной литературы, вы сможете найти более ста исследований, которые показывают, что кормление лабораторных животных “высокожирной диетой” приводит к массивному дисбактериозу кишечника, нарушению проницаемости кишечника, и системному воспалению. Люди часто цитируют эти исследования, чтобы предположить, что диета с высоким содержанием жиров также может быть нездоровой для микробиома кишечника человека.
Однако, изучив методы исследования в этих работах, вы увидите, что ”диету с высоким содержанием жиров», используемая в большинстве исследований на животных, точнее будет назвать диетой с высоким содержанием рафинированного соевого масла, свиного сала и рафинированного сахара и очень низким содержанием клетчатки. 5 Доктор Крейг Уорден, профессор Калифорнийского университета в Дэвисе, назвал это «эквивалентом для мыщей свиных шкурок, ребрышек и кока-колы”6, предположив, что эта “диета с высоким содержанием жиров” гораздо больше отражает стандартную американскую диету, чем любая тщательно продуманная кетогенная диета.
(Кетогенная) диета быстро и воспроизводимо изменяет микробиом кишечника человека.
Изменения микробиома кишечника, вызванные кетогенной диетой, могут быть защитными при рассеянном склерозе.
А как насчет долгосрочных исследований?
В одном исследовании, опубликованном в журнале Frontiers in Microbiology в 2017 году, изучались долгосрочные эффекты кетогенной диеты на фекальную микробиоту у 25 пациентов с рассеянным склерозом.8
Рассеянный склероз (РС) — это аутоиммунное заболевание, поражающее нервную систему. Как и многие аутоиммунные заболевания, рассеянный склероз связан с патологиями кишечника. Фактически, некоторые исследователи подозревают, что дисбактериоз кишечника и кишечная проницаемость могут в первую очередь предшествовать развитию аутоиммунитета.9 Таким образом, следует, что если кетогенная диета может значительно улучшить симптомы рассеянного склероза,10 она, вероятно, не вредит кишечнику и может даже улучшать здоровье кишечника. Итак, что же обнаружило исследование?
Пациенты с рассеянным склерозом имели тенденцию к снижению показателей Roseburia, Bacteroides и Faecalibacterium prasunitzii на исходном уровне по сравнению со здоровыми людьми. Затем они сели на кетогенную диету на 6 месяцев.
Авторы пишут: «Эффект кетогенной диеты был двухфазным. В краткосрочной перспективе концентрация и разнообразие бактерий еще больше снизились. Они начали восстанавливаться на 12 неделе и значительно превысили базовые значения после 23–24 недель кетогенной диеты ».8
Это говорит о том, что, хотя краткосрочные диетические изменения могут быстро изменить состав микробиоты кишечника, нам, возможно, потребуется взглянуть на долгосрочные диетические изменения и собрать образцы в нескольких временных точках, чтобы определить истинный эффект диетического вмешательства, такого как кето.
Кетогенная диета увеличивает уровень кетонов в кишечнике, снижает количество бифидобактерий и уменьшает количество провоспалительных клеток Th17 в кишечнике (НОВИНКА!)
Исследование, недавно опубликованное лабораторией доктора Питера Тернбо (и представленное доктором Тернбо на Саммите виртуального микробиома 2020 года), подтвердило, что кетогенная диета может изменить структуру и функцию микробиоты кишечника.11
Рисунок 4.

Микробиом кишечника создает противосудорожные эффекты кетогенной диеты.
Кетогенные диеты часто используются для лечения эпилепсии, не поддающейся лечению лекарствами. Несмотря на невероятную эффективность, то, как именно кетогенная диета влияет на активность мозга, оставалось невыясненным на протяжении десятилетий.
Однако исследование, опубликованное в журнале Cell в мае 2018 года группой доктора Элейн Сяо, позволяет предполажить, что благотворное влияние кетогенной диеты на эпилепсию опосредуется микробиомом кишечника.13 Другими словами, если бы кетогенная диета не изменяла бы микробиом, то не смогла бы эффективно предотвращать судороги.

Исследование проводилось на мышиной модели эпилепсии (с использованием других штаммов, чем тот, который я упоминала ранее). Как и в предыдущих исследованиях, они смогли показать, что кормление мышей кетогенной диетой защищает их от судорог. Однако они также продемонстрировали, что лечение мышей антибиотиками широкого спектра действия отменяет защиту кетогенной диеты от судорог. Точно так же стерильные мыши без микробиоты, которые выращиваются в стерильных инкубаторах и не имеют кишечного микробиома, не были защищены от судорог даже при соблюдении кетогенной диеты.
Интересно, что кетогенная диета в этом исследовании снизила микробное разнообразие, но увеличила численность Akkermansia muciniphila и Parabacteroides spp. Исследователи задались вопросом, ответственны ли эти два микроба за защиту от приступов, и попытались лечить мышей, получавших обычную высокоуглеводную диету, с помощью Akkermansia и Parabacteroides. Удивительно, но это обеспечило защиту от судорожных припадков.
Дальнейшие механистические эксперименты выявили бактериальный путь, повышающий соотношение тормозящего нейромедиатора ГАМК по сравнению с возбуждающим нейротрансмиттером глутаматом в головном мозге. ГАМК успокаивает активность мозга, поэтому это объясняет уменьшение судорог, а также может объяснить, почему многие люди считают кетогенную диету полезной для снижения беспокойства.
Теперь, когда мы рассмотрели все соответствующие экспериментальные данные на людях и животных, которые у нас есть на сегодняшний день, я хочу погрузиться в несколько механистических объяснений изменений физиологии кишечника, которые происходят при кетогенной диете.
Разве кето не снизит выработку бутирата?
К этому моменту вы можете спросить, а как же кишечник выживает без ферментируемых углеводов?
Это справедливый вопрос. Мы знаем, что кишечные бактерии метаболизируют сложные углеводы с образованием короткоцепочечных жирных кислот (SCFA) (short-chain fatty acids), таких как ацетат, пропионат и бутират. Бутират SCFA выполняет важные сигнальные функции в кишечнике и хорошо известен как предпочтительный источник топлива для эпителиальных клеток кишечника. Опубликованные оценки показывают, что бутират обеспечивает около 70 процентов энергии, необходимой эпителиальным клеткам толстой кишки. И нам нужен регулярный запас бутирата для поддержания барьерной функции кишечника… верно?
Неа. Оказывается, есть несколько других молекул, которые могут выполнять многие из сигнальных функций бутирата и служить источником топлива для эпителиальных клеток кишечника! Фактически, это представление о «предпочтительном» источнике топлива может быть искажено при изучении людей (и грызунов), которые едят большое количество углеводов. Другими словами, производство бутирата может быть уменьшено на кетогенной диете, но другие молекулы могут занять его место, чтобы помочь поддерживать барьерную функцию кишечника.
Keтоновые тела и изобутират могут заместить бутират
Есть три молекулы, которые могут заменить бутират: изобутират, ацетоацетат и бета-гидроксибутират.
Изобутират — это метаболит белкового брожения, который обычно вырабатывается на более низких уровнях, чем бутират. Когда бутирата меньше, изобутират может поглощаться из просвета кишечника эпителиальными клетками кишечника и метаболизироваться для получения энергии. В исследовании 2014 года, о котором я упоминал выше, было обнаружено повышенное содержание изобутирата в фекалиях у людей, потребляющих кетогенную диету животного происхождения.14
Более того, изобутират может стимулировать те же рецепторы в кишечнике, что и бутират (GPR41, GPR43 и GPR109a), чтобы стимулировать секрецию слизи, высвобождение антимикробных пептидов и иммунную регуляцию.15 И хотя изобутират может продуцироваться на более низких уровнях при умеренно-высоком уровне белковая диета, чем бутират, будет производиться на высокоуглеводной диете,14 было показано, что изобутират является более мощным стимулятором GPR41 (FFAR3), одного из основных рецепторов бутирата, чем сам бутират.16 Другими словами, то, чего не хватает изобутирату в концентрации, компенсируется более сильным воздействием!
Две другие молекулы, ацетоацетат и бета-гидроксибутират (βHB), являются двумя основными кетоновыми телами, вырабатываемыми печенью. Как и бутират, βHB может также стимулировать GPR109a, уменьшая воспаление кишечника. Однако наиболее примечательно, что и βHB, и ацетоацетат являются промежуточными продуктами метаболизма бутирата. Другими словами, когда бутират поглощается эпителиальными клетками кишечника, он фактически сначала превращается в βHB, а затем в ацетоацетат, прежде чем будет расщепляться для получения энергии.17
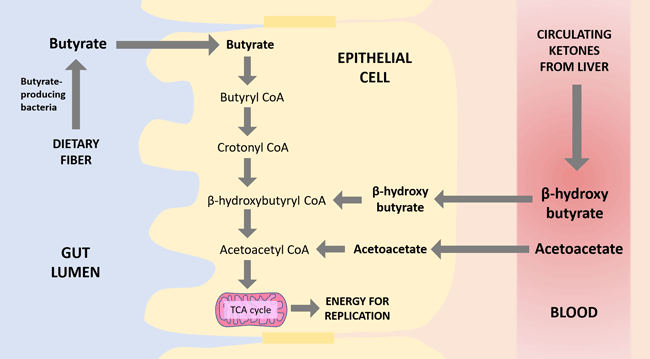
Известно, что эпителиальные клетки кишечника экспрессируют транспортер монокарбоксилата MCT1 на базолатеральной поверхности (сторона клетки, ближайшая к кровотоку).18 MCT1, как известно, переносит кетоны и особенно экспрессируется в клетках, которые используют кетоновые тела для получения энергии. Несколько более старых работ предполагают, что действительно эпителиальные клетки кишечника способны утилизировать кетоновые тела из сосудистого русла.19,20
Кетоны могут помочь преодолеть нарушение усвоения бутирата
Возможность использовать кетоны вместо бутирата может показаться нецелесообразной, пока вы не поймете, что у многих людей с воспаленным кишечником повреждены слизистые оболочки, из-за которых нарушается поглощение бутирата.
Так что это значит? Если у вас здоровый микробиом и слизистая оболочка кишечника, бутират, вероятно, хорошо справится со всеми потребностями вашего кишечника, и в кетонах нет необходимости.
Однако, если у вас:
- есть язвенный колит или другое повреждение слизистой оболочки, при котором нарушается захват бутирата,
- имеется дисбактериоз кишечника, характеризующийся отсутствием продуцентов бутирата,
- вы находитесь на ограничительной диете, такой как диета с низким содержание FODMAP или SCD, что приводит к снижению выработки бутирата,
Возможно, тогда будет разумно попробовать лечебный пищевой кетоз для поддержки метаболизма эпителиальных клеток кишечника, по крайней мере, до лечения основных патологий кишечника и заживления слизистой оболочки кишечника.
К сожалению, было проведено мало исследований кетогенных диет при болезни Крона, язвенном колите или синдроме раздраженного кишечника. В одном клиническом случае было обнаружено, что палеолитическая кетогенная диета вызвала полную ремиссию у мальчика с тяжелой болезнью Крона.21
Второй отчет показал, что низкоуглеводная диета с добавлением кетоновых эфиров значительно снижает воспаление и улучшает качество жизни у пациента с болезнью Крона.22
Другое исследование 13 пациентов с синдромом раздраженного кишечника с преобладанием диареи (СРК-Д) показало, что 10 сообщили об облегчении симптомов во время 4-недельной кетогенной диеты.23
Как ни странно, многие люди с язвенным колитом находили облегчение от кетогенных диет, в том числе в народном здоровье блогер и биохимик Робб Вольф (Robb Wolf).
Насколько мне известно, на сегодняшний день нет исследований, оценивающих влияние кетонов или кетогенной диеты на барьерную функцию кишечника. Это довольно простой эксперимент, я хотела бы увидеть, чтобы кто-нибудь его провел.
Экзогенные кетоны могут повысить уровень бутиратов в кишечнике (НОВИНКА)
Учитывая, что кетогенная диета довольно ограничительна, многие люди стали использовать сложные эфиры или соли кетонов для достижения кетоза.
Другие люди могут использовать сложные эфиры или соли кетонов в дополнение к кетогенной диете, чтобы достичь более глубокого состояния кетоза. Интересно, что некоторые данные in vitro показывают, что, по крайней мере, у некоторых людей сложные эфиры или соли кетонов могут повышать уровень бутирата в кишечнике. В исследовании 2020 года, опубликованном в Scientific Reports, изучалась динамика солей бета-гидроксибутирата в 12 образцах фекальной микробиоты человека в камере для ферментации in vitro.24 В семи образцах (утилизаторы βHB) более 54 процентов βHB метаболизировалось через 30 часов ферментации. Это было связано с увеличением численности рода Coprococcus, известного продуцента бутирата, что коррелировало с увеличением производства бутирата. В других пяти образцах фекалий (неутилизаторы βHB) метаболизировалось менее 19 процентов BHB, и никаких изменений в фекальном бутирате не наблюдалось.
Авторы предположили, что микробы превращали βHB в бутират. Эта идея подтверждается исследованием 2018 года, опубликованным в Cell Metabolism, в котором было обнаружено, что прерывистое голодание у грызунов приводит к обогащению микробных путей, связанных с синтезом и разложением кетоновых тел.25 Другой возможный механизм — активация PPAR-гамма и поддержание гипоксии в кишечнике, которая, в свою очередь, поддерживает популяции продуцентов бутирата в кишечнике.
Может ли жир быть источником бутирата? (НОВИНКА)
С тех пор как я впервые опубликовала эту статью в 2018 году http://galinaleb.com/keto-diet-your-gut/, я получила несколько вопросов о том, может ли масло или топленое масло выступать в качестве значительного источника бутирата при диете с низким содержанием углеводов и высоким содержанием жиров.
Сливочное масло является наиболее концентрированным пищевым источником бутирата, в нем содержится около 3-4 процентов бутирата по весу. Гхи или топленое масло, вероятно, содержит около 5-6 процентов бутирата из-за более высокого содержания жира, хотя я не видел опубликованных анализов.
Ссылаясь на мои собственные химические рассчеты (кто-нибудь, пожалуйста, проверьте мою математику), допустим, у вас есть четверть стакана масла: 1/4 стакана масла составляет 14 граммов, поэтому 0,04 процента бутирата x 14 граммов = 0,56 грамма бутирата. Разделите это на молекулярную массу бутирата (88,11 г / моль), чтобы получить 0,006 моль = 6 ммоль бутирата на каждую 1/4 стакана масла.
Концентрация бутирата в здоровом кишечнике составляет 70-140 ммоль/л в проксимальном отделе толстой кишки и 20-70 ммоль / л в дистальном отделе толстой кишки. Ежедневная продукция SCFAs в толстой кишке оценивается в пределах 300-400 ммоль, и теоретически может достигать 800 ммоль в день.
Итак, 6 ммоль определенно немаловажное количество и, безусловно, может иметь терапевтический эффект. Это все еще относительно мало по сравнению с тем, что вы получаете от ферментации клетчатки или с количеством клеточной энергии, которое, я подозреваю, вы можете получить от кетоновых тел, но сравнимо с количеством, которое вы можете получить от двух капсул пробутирата.
Другими словами, сливочное масло или топленое масло определенно могут быть компонентом здоровой кетогенной диеты, но я бы не стала продвигать масло только ради бутирата.
Кетоны опосредуют гомеостаз стволовых клеток тонкого кишечника (НОВИНКА!)
Исследование, опубликованное в журнале Cell в конце 2019 года группой исследователей из Массачусетского технологического института, показало, что передача сигналов кетоновых тел регулирует нормальную функцию кишечных стволовых клеток и их способность реагировать на травмы.

ISCs are tightly controlled by a number of different growth factors that influence their development. Previous studies had shown that dietary nutrients play an important role in determining ISC function, but nobody had yet looked at ketone bodies and their potential role.
The research group first found that the ketone-generating enzyme HMG-CoA synthase 2 (HMGCS2) was enriched in small intestinal stem cells. HMGCS2 is found in many different tissues and is known to limit the rate of ketone formation.
Эпителий кишечника сильно складчатый, с пиками (ворсинками) и впадинами (криптами) на поверхности эпителия. Кишечные стволовые клетки (ISC) находятся на дне каждой крипты и отвечают за обновление всего эпителия кишечника каждые несколько дней или за восстановление любых повреждений.
ISC жестко контролируются рядом различных факторов роста, влияющих на их развитие. Предыдущие исследования показали, что диетические питательные вещества играют важную роль в определении функции ISC, но никто еще не изучал кетоновые тела в этом контексте и их потенциальную роль.
Исследовательская группа сначала обнаружила, что фермент HMG-CoA-синтаза 2 (HMGCS2), производящий кетоны, обогащен стволовыми клетками тонкого кишечника. HMGCS2 обнаружен во многих различных тканях и, как известно, ограничивает скорость образования кетонов.
Ablating the Hmgcs2 gene in the intestine diminished beta-hydroxybutyrate levels in the crypts and compromised stem cell function and regeneration of the gut epithelium after injury. Giving exogenous (supplemental) βHB rescued stem cell function and partially restored intestinal regeneration.
They next investigated the effects of a ketogenic diet, and found that it increased HMGCS2 expression, ISC number, function, and post-injury regeneration. In contrast, a glucose-supplemented diet suppressed intestinal stem cell ketogenesis and skew differentiation of stem cells towards goblet and Paneth cells.
Notably, once stem cells had differentiated into mature epithelial cells and migrated up out of the crypt, they expressed very little HMGCS2. This suggests that mature epithelial cells do NOT possess the ability to generate large amounts of ketones through the classical ketogenic pathway (via condensation of two molecules of acetyl coA), though we know that they do have the ability to utilize ketones.
Удаление гена Hmgcs2 в кишечнике снижает уровни бета-гидроксибутирата в криптах и нарушает функцию стволовых клеток и регенерацию эпителия кишечника после повреждения.
Экзогенный (дополнительный) βHB спасает функцию стволовых клеток и частично восстанавливает регенерацию кишечника.
Затем они исследовали эффекты кетогенной диеты и обнаружили, что она увеличивает экспрессию HMGCS2, количество ISC, функцию и регенерацию после травм. Напротив, диета с добавлением глюкозы подавляла кетогенез стволовых клеток кишечника и искажала дифференцировку стволовых клеток в сторону бокаловидных клеток и клеток Панета. Примечательно, что после того, как стволовые клетки дифференцировались в зрелые эпителиальные клетки и мигрировали из крипты, они экспрессировали очень мало HMGCS2. Это говорит о том, что зрелые эпителиальные клетки НЕ обладают способностью генерировать большие количества кетонов классическим кетогенным путем (посредством конденсации двух молекул ацетил-коА), хотя мы знаем, что они действительно обладают способностью использовать кетоны.
Таким образом, из этого следует, что если (1) мы наблюдаем высокие уровни кетонов в зрелых эпителиальных клетках кишечника на кетогенной диете (как мы это делали в статье Тернбо), и (2) они не генерируются в зрелых эпителиальных клетках (поскольку предположительно из-за отсутствия HMGCS2 в этой статье), то кетоны почти наверняка поступают из обращения.
Авторы пишут:
«Поскольку экзогенные кетоны исправляют потерю Hmgcs2 in vitro и in vivo, печень или другие неинтестинальные источники кетонов могут заменять или дополнять генерируемые ISC кетоны при KTD-опосредованной регенерации, когда уровни циркулирующих кетонов сильно повышены».
But don’t high-fat diets increase LPS absorption?
Another common argument for avoiding high-fat diets is that they increase intestinal absorption of lipopolysaccharide (LPS). LPS is a molecule found in the cell walls of gram-negative bacteria. If it gets into circulation, it can cause low-grade, systemic inflammation.
To really understand this mechanism, we need to review how fats are digested and absorbed. When we eat fat, specialized cells in the small intestine release a hormone called cholecystokinin (CCK). CCK stimulates the gallbladder to secrete bile into the small intestine. Here, the bile acids surround fat molecules, helping to make them water soluble (much like dish detergent helps to emulsify oil).
It turns out that LPS has a high affinity for these water-soluble packages, called micelles. Micelles eventually diffuse toward the gut epithelium, where their contents (including LPS) are picked up by gut epithelial cells. The epithelial cells repackage the lipids and LPS into chylomicrons, which can then be exported to the liver via the lymphatics (the vessels that carry the lymph of the immune system).
Другой распространенный аргумент в пользу отказа от диет с высоким содержанием жиров заключается в том, что они увеличивают всасывание липополисахаридов (ЛПС) в кишечнике. ЛПС — это молекула, обнаруженная в клеточных стенках грамотрицательных бактерий.
Попадание в кровоток может вызвать слабое системное воспаление. Чтобы по-настоящему понять этот механизм, нам нужно рассмотреть, как перевариваются и усваиваются жиры. Когда мы едим жир, специализированные клетки тонкого кишечника выделяют гормон холецистокинин (ХЦК). CCK стимулирует желчный пузырь выделять желчь в тонкий кишечник. Здесь желчные кислоты окружают молекулы жира, помогая сделать их водорастворимыми (так же, как средство для мытья посуды помогает эмульгировать масло). Оказалось, что LPS имеет высокое сродство к этим водорастворимым пакетам, называемым мицеллами. В конечном итоге мицеллы диффундируют к эпителию кишечника, где их содержимое (включая ЛПС) улавливается эпителиальными клетками кишечника. Эпителиальные клетки переупаковывают липиды и ЛПС в хиломикроны, которые затем могут быть экспортированы в печень через лимфатические сосуды (сосуды, несущие лимфу иммунной системы).
When we consume more long chain fatty acids, our body makes more of these chylomicrons, so more LPS can hitch a ride in this fashion.26 Indeed, fat-enriched meals have been shown to moderately increase serum levels of LPS in both mice and humans.27,28 While this is absolutely a real phenomenon and worth considering, I believe this is generally a non-issue for several reasons.
First, several studies suggest that the transport of LPS by chylomicrons may confer an advantage because it favors clearance of LPS by the liver, reducing the toxicity of LPS.29,30 Moreover, chylomicrons also have an innate ability to inactivate LPS.31 Altogether, the increased absorption of LPS appears to reduce inflammation in the gut mucosa.32
This is especially important since the primary mode of systemic exposure to LPS is not through fat absorption, but through a leaky gut! When the gut is permeable, large amounts of LPS can leak into the submucosa and bloodstream, causing localized gut immune responses and systemic inflammation.
In other words, compared to full-blown intestinal permeability, chylomicron-induced LPS absorption is likely a drop in the bucket. (In fact, for those who are dealing with severe intestinal permeability, chylomicron-induced detoxification of LPS may even reduce inflammation enough to facilitate healing of the gut epithelium.)
Furthermore, if fat-induced LPS absorption was an issue, we would expect to see increased systemic inflammation in those fed a high-fat ketogenic diet. On the contrary, subjects fed ketogenic diets almost universally experience a reduction in systemic inflammation.33
Alright so, hopefully by this point, I’ve convinced you that high-fat diets are not to be feared for their lack of butyrate or increased absorption of LPS. In the next section, we’ll see how bile acids might also contribute to a healthier gut.
Когда мы потребляем больше длинноцепочечных жирных кислот, наш организм вырабатывает больше этих хиломикронов, поэтому большее количество ЛПС может помочь подобным образом.26 Действительно, было показано, что обогащенная жирами пища умеренно увеличивает уровни ЛПС в сыворотке как у мышей, так и у людей.27,28 Хотя это абсолютно реальное явление и заслуживает рассмотрения, я считаю, что в целом это не проблема по нескольким причинам.
Во-первых, несколько исследований показывают, что транспорт ЛПС хиломикронами может иметь преимущество, поскольку он способствует выведению ЛПС печенью, снижая токсичность ЛПС.29,30 Более того, хиломикроны также обладают врожденной способностью инактивировать ЛПС.31 В целом, повышенное всасывание ЛПС, по-видимому, уменьшает воспаление слизистой оболочки кишечника.32
Это особенно важно, поскольку основной способ системного воздействия ЛПС — это не абсорбция жира, а протекающий кишечник! Когда кишечник проницаем, большое количество ЛПС может просачиваться в подслизистую основу и кровоток, вызывая локальные иммунные реакции кишечника и системное воспаление.
Другими словами, по сравнению с полной кишечной проницаемостью, абсорбция ЛПС, вызванная хиломикроном, скорее всего, капля в море. (Фактически, для тех, кто имеет дело с тяжелой кишечной проницаемостью, детоксикация ЛПС, вызванная хиломикроном, может даже уменьшить воспаление в достаточной степени, чтобы облегчить заживление эпителия кишечника.)
Кроме того, если бы возникла проблема с абсорбцией ЛПС, вызванной жиром, мы бы ожидали увидеть усиление системного воспаления у тех, кто питался кетогенной диетой с высоким содержанием жиров. Напротив, у субъектов, соблюдающих кетогенную диету, почти всегда наблюдается уменьшение системного воспаления.
Ну хорошо, надеюсь, к этому моменту я убедила вас, что диет с высоким содержанием жиров не следует опасаться из-за недостатка бутирата или повышенного всасывания ЛПС. В следующем разделе мы увидим, как желчные кислоты могут способствовать здоровью кишечника.
Желчные кислоты имеют решающее значение для здоровья кишечника
Some people have also suggested that a high-fat diet might be detrimental to the gut microbiota and gut barrier because it stimulates increased secretion of bile acids. Generally speaking, the more fat you eat, the more bile is released into the small intestine.
Indeed, some studies have shown that sustained exposure of the gut barrier to high concentrations of bile acids results in intestinal permeability. However, physiologic doses of bile acids have been shown to support barrier function, inducing the secretion of mucus from goblet cells, promoting epithelial cell migration, and boosting gut innate immune defenses.34
Bile acids also have antimicrobial properties, helping to regulate the gut microbiota, and may particularly protect against small intestinal dysbiosis.35 Several studies also suggest that bile acids activate enteroendocrine cells to release serotonin, which helps promote gut motility.36
Exploring the ins and outs of every type of conjugated and deconjugated bile acid is beyond the scope of this article, and something I’ll hope to cover in a future post. Overall, I do not believe there is sufficient evidence to suggest that the physiologic increase of bile acids seen with a ketogenic diet is harmful to the gut microbiota or gut barrier function.
Некоторые люди также предполагают, что диета с высоким содержанием жиров может быть вредной для кишечной микробиоты и кишечного барьера, потому что она стимулирует повышенную секрецию желчных кислот. Как правило, чем больше жира вы едите, тем больше желчи попадает в тонкий кишечник.
Действительно, некоторые исследования показали, что длительное воздействие высоких концентраций желчных кислот на барьер кишечника приводит к кишечной проницаемости. Однако было показано, что физиологические дозы желчных кислот поддерживают барьерную функцию, вызывая секрецию слизи бокаловидными клетками, способствуя миграции эпителиальных клеток и повышая врожденную иммунную защиту кишечника (34).
Желчные кислоты также обладают антимикробными свойствами, помогая регулировать микробиоту кишечника и могут особенно защищать от дисбактериоза тонкого кишечника35. Некоторые исследования также предполагают, что желчные кислоты активируют энтероэндокринные клетки для высвобождения серотонина, который способствует подвижности кишечника.36
Изучение тонкостей каждого типа конъюгированной и деконъюгированной желчной кислоты выходит за рамки этой статьи, и я надеюсь осветить это в одной из следующих статей. В целом, я не верю, что есть достаточные доказательства того, что физиологическое увеличение желчных кислот, наблюдаемое при кетогенной диете, вредно для кишечной микробиоты или функции кишечного барьера.
What about the carnivore diet?
The carnivore diet has recently been touted as a cure-all for a wide variety of diseases. While an all-meat diet might be beneficial as a short-term therapeutic diet and, anecdotally, many people experience improvement in their symptoms, there is limited data on the long-term safety of this dietary approach.
It is theoretically possible to get all of your nutrients from an animal-based diet, assuming that you eat nose-to-tail and consume all parts of the animal. Interestingly, the short-term animal-based diet featured in the study I mentioned above was associated with increased expression of bacterial genes for vitamin biosynthesis.14 As a low residue diet, a reduction in gut inflammation may also improve nutrient status in the short-term. However, we know very little about how the carnivore diet might impact nutrient status, hormones, fertility, and thyroid function in the long-term.
Moreover, there is no evidence that any ancestral population lived on only meat or only plants. Even the Inuit and other populations that lived in far northern latitudes went to great lengths to forage plants when they could or boost their fertility in other ways. In his book “Nutrition and Physical Degeneration, A Comparison of Primitive and Modern Diets and Their Effects”, Weston A. Price wrote:
“Among the Indians in the moose country near the Arctic Circle a larger percentage of the children were born in June than in any other month. This was accomplished, I was told, by both parents eating liberally of the thyroid glands of the male moose as they came down from the high mountain areas for the mating season, at which time the large protuberances carrying the thyroids under the throat were greatly enlarged.”
В последнее время диета плотоядных животных рекламируется как панацея от множества болезней. Хотя полностью мясная диета может быть полезной в качестве краткосрочной терапевтической диеты, и, как известно, многие люди испытывают улучшение своих симптомов, данные о долгосрочной безопасности этого диетического подхода ограничены.
Теоретически возможно получить все ваши питательные вещества из диеты на основе животных продуктов, если вы едите все части хживотного от носа до хвоста и потребляете все части животного. Интересно, что краткосрочная диета на основе животных продуктов, представленная в исследовании, о котором я упоминала выше, была связана с повышенной экспрессией бактериальных генов для биосинтеза витаминов.14 Как и диета с низким содержанием клетчатки, уменьшение воспаления кишечника может также улучшить статус питательных веществ в краткосрочной перспективе.
Однако мы очень мало знаем о том, как диета плотоядных может повлиять на статус питательных веществ, гормоны, фертильность и функцию щитовидной железы в долгосрочной перспективе. Более того, нет никаких свидетельств того, что какое-либо древнее население питалось только мясом или только растениями. Даже инуиты и другие народы, жившие в далеких северных широтах, пошли на многое, чтобы собрать растения, когда они могли, или повысить свою плодовитость другими способами. В своей книге «Питание и физическая дегенерация, сравнение примитивных и современных диет и их последствий» Уэстон А. Прайс писал: «Среди индейцев, проживающих в стране лосей недалеко от полярного круга, в июне родилось больше детей, чем в любой другой месяц. Мне сказали, что это было достигнуто, когда оба родителя обильно поедали щитовидные железы самца лося, когда они спустились с высокогорных районов на период спаривания, когда большие выступы, несущие щитовидные железы под глоткой, были значительно увеличены… »
In other words, these cultures had the traditional wisdom to self-medicate with thyroid glands of other animals to make up for the reduced fertility conferred by their lack of plant foods. Most modern “carnivores” are not doing this, and many are consuming muscle meat alone.
I certainly empathize with those who have found the carnivore diet to provide relief of symptoms. That being said, I believe in most cases, a therapeutic ketogenic diet could be just as effective and that the need to go complete carnivore to relieve symptoms is a sign of an underlying gut infection. Once this is addressed, the ideal diet likely includes some form of plant foods.
Другими словами, у этих культур была традиционная мудрость заниматься самолечением щитовидной железой других животных, чтобы компенсировать снижение фертильности, вызванное отсутствием у них растительной пищи.
Большинство современных «хищников» этого не делают, и многие едят только мышечное мясо.
Я определенно сочувствую тем, кто считает, что диета плотоядных помогает облегчить симптомы. При этом я считаю, что в большинстве случаев терапевтическая кетогенная диета может быть столь же эффективной, и что необходимость полностью отказаться от плотоядности для облегчения симптомов является признаком основной инфекции кишечника. Как только это будет решено, идеальная диета, вероятно, будет включать в себя растительную пищу.
Когда кетогенная диета не лучшая идея:сероводород (НОВИНКА)
Итоговые выводы и практические советы по здоровью кишечника на кетогенной диете.
To summarize, there is no clear evidence that a well-designed high-fat or ketogenic diet is detrimental to the gut microbiota or gut barrier function. In fact, keto-induced changes in the gut microbiota and gut barrier may even be the reason we see so many benefits from ketosis.
Moreover, we don’t really know what constitutes a healthy gut microbiota, and ketones and isobutyrate can replace the short-chain fatty acid butyrate that we typically think of as crucial for gut barrier function. Several case reports indicate that a ketogenic diet may reduce inflammation and improve quality of life in IBS and IBD.
I want to stress that I do not believe that a ketogenic diet is right for everyone. My intention with this article was not to suggest that everyone with a gut issue should try a ketogenic diet. I simply wanted to clear up a lot of the confusion and provide a more complete discussion of the evidence for ketogenic diets in relation to gut health.
Есть правильные и неправильные способы соблюдать кетогенную диету, когда речь идет о здоровье кишечника. Кетогенная диета с высоким содержанием рафинированных масел из семян и обработанного мяса не принесет такой же терапевтической пользы для кишечника, как диета, включающая полезные жиры, пастбищное мясо и много некрахмалистых овощей.
В связи с этим, вот семь моих главных советов, как правильно поступать со своим кишечником при потреблении высокожирной или кетогенной диеты:
1) Сосредоточьтесь на высококачественных жирах, таких как авокадо, масло авокадо, оливковое масло, жирная рыба, кокосовое масло, пастбищное топленое масло, сливочное масло и т. д. Постарайтесь получить смесь мононенасыщенных, полиненасыщенных и насыщенных жиров. Избегайте есть обработанные и рафинированные масла, такие как рапсовое, кукурузное и соевое масло.
** Если вы планируете оставаться на кетогенной диете в течение длительного времени, я рекомендую сделать полный профиль сердечно-сосудистой системы после того, как вы соблюдаете диету в течение 1-2 месяцев. У небольшой группы людей («гиперреагенты») будет увеличиваться количество частиц ЛПНП, и им может потребоваться изменить потребление жиров или рассмотреть вариант модифицированной кетогенной диеты, чтобы гарантировать, что они не увеличивают риск сердечно-сосудистых заболеваний.
2) Ешьте овощи (не содержащие крахмала)! То, что вам не обязательно нужен бутират, не означает, что вам следует экономить на овощах. Старайтесь есть как сырые, так и вареные овощи всех видов и цветов.
3) Побалуйте себя ягодами. Ягоды являются отличным низкоуглеводным источником пребиотической клетчатки, избирательно способствующей росту полезных бактерий.
4) Пейте кофе и какао. Полифенолы способствуют росту полезных бактерий, поэтому употребляйте кофе и какао в количестве, которое хорощо переносит ваш организм. Люди с сильно нарушенной кишечной проницаемостью или аутоиммунитетом могут сначала отказаться от этих продуктов.
5) Учитывайте плотность питательных веществ и ешьте все части животного от носа до хвоста. Употребляйте субпродукты, моллюсков, морепродукты и обязательно сбалансируйте мясные продукты, богатые метионином, с богатыми глицином продуктами животного происхождения, такими как коллаген и костный бульон.
6) Экспериментируйте! Лучший способ узнать, работает ли кето для вас, — это попробовать его в течение нескольких недель и посмотреть, как вы себя чувствуете. Уделяйте особое внимание своей энергии, состоянию кожи, настроению, продуктивности, пищеварению и дефекации.
7) Попробуйте побыть в «кето-зоне». Если у вас нет веских причин находиться в диетическом кетозе, нет необходимости находиться в кето-диете бесконечно. Поддерживая потребление углеводов на уровне 20-120 граммов (в зависимости от уровня вашей активности), вы можете легко входить и выходить из кетоза. Фактически, это может помочь кишечнику и микробиому поддерживать максимальную метаболическую гибкость. На этом пока все!
Ссылки:
- Jiang, H. et al. Altered fecal microbiota composition in patients with major depressive disorder. Brain Behav. Immun. 48, 186–194 (2015).
- Johnson, K. V.-A. & Burnet, P. W. J. Microbiome: Should we diversify from diversity? Gut Microbes 7, 455–458 (2016).
- Schnorr, S. L. et al. Gut microbiome of the Hadza hunter-gatherers. Nature Communications 5, 3654 (2014).
- Role of microorganisms in the evolution of animals and plants: the hologenome theory of evolution | FEMS Microbiology Reviews | Oxford Academic. https://academic.oup.com/femsre/article/32/5/723/2398937.
- Warden, C. H. & Fisler, J. S. Comparisons of Diets Used in Animal Models of High-Fat Feeding. Cell Metabolism 7, 277 (2008).
- Majority of studies of high-fat diets in mice inaccurately portrayed. http://secure.ucdmc.ucdavis.edu/welcome/features/20080702_diet_warden/index.html.
- Borghjid, S. & Feinman, R. D. Response of C57Bl/6 mice to a carbohydrate-free diet. Nutr Metab (Lond) 9, 69 (2012).
- Swidsinski, A. et al. Reduced Mass and Diversity of the Colonic Microbiome in Patients with Multiple Sclerosis and Their Improvement with Ketogenic Diet. Front Microbiol 8, 1141 (2017).
- Fasano, A. & Shea-Donohue, T. Mechanisms of Disease: the role of intestinal barrier function in the pathogenesis of gastrointestinal autoimmune diseases. Nature Reviews Gastroenterology & Hepatology 2, 416–422 (2005).
- Storoni, M. & Plant, G. T. The Therapeutic Potential of the Ketogenic Diet in Treating Progressive Multiple Sclerosis. Multiple Sclerosis International https://www.hindawi.com/journals/msi/2015/681289/abs/ (2015) doi:10.1155/2015/681289.
- Ang, Q. Y. et al. Ketogenic Diets Alter the Gut Microbiome Resulting in Decreased Intestinal Th17 Cells. Cell 181, 1263-1275.e16 (2020).
- Zambrano-Zaragoza, J. F., Romo-Martínez, E. J., Durán-Avelar, Ma. de J., García-Magallanes, N. & Vibanco-Pérez, N. Th17 Cells in Autoimmune and Infectious Diseases. Int J Inflam 2014, (2014).
- Olson, C. A. et al. The Gut Microbiota Mediates the Anti-Seizure Effects of the Ketogenic Diet. Cell 173, 1728-1741.e13 (2018).
- David, L. A. et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 505, 559–563 (2014).
- Rahim, A. & Bin, M. B. H. Gut microbial metabolome: regulation of host metabolism by SCFAs. (2016).
- Le Poul, E. et al. Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation. J. Biol. Chem. 278, 25481–25489 (2003).
- Henning, S. J. & Hird, F. J. Ketogenesis from butyrate and acetate by the caecum and the colon of rabbits. Biochem. J. 130, 785–790 (1972).
- Iwanaga, T. & Kishimoto, A. Cellular distributions of monocarboxylate transporters: a review. Biomed. Res. 36, 279–301 (2015).
- Roediger, W. E. W. Utilization of Nutrients by Isolated Epithelial Cells of the Rat Colon. Gastroenterology 83, 424–429 (1982).
- Hanson, P. J. & Parsons, D. S. Factors affecting the utilization of ketone bodies and other substrates by rat jejunum: effects of fasting and of diabetes. The Journal of Physiology 278, 55–67 (1978).
- Tóth, C., Dabóczi, A., Howard, M., Miller, N. J. & Clemens, Z. Crohn’s disease successfully treated with the paleolithic ketogenic diet. International Journal of Case Reports and Images (IJCRI) 7, 570–578 (2016).
- Lowery, R. P., Wilson, J. M., Sharp, M. H., Wilson, G. J. & Wagner, R. The effects of exogenous ketones on biomarkers of CrohnâÂÂs disease: A case report. Journal of Gastroenterology and Digestive Diseases 2, (2017).
- Austin, G. L. et al. A Very Low-Carbohydrate Diet Improves Symptoms and Quality of Life in Diarrhea-Predominant Irritable Bowel Syndrome. Clinical Gastroenterology and Hepatology 7, 706-708.e1 (2009).
- Sasaki, K., Sasaki, D., Hannya, A., Tsubota, J. & Kondo, A. In vitro human colonic microbiota utilises D-β-hydroxybutyrate to increase butyrogenesis. Scientific Reports 10, 8516 (2020).
- Cignarella, F. et al. Intermittent Fasting Confers Protection in CNS Autoimmunity by Altering the Gut Microbiota. Cell Metabolism 27, 1222-1235.e6 (2018).
- Ghoshal, S., Witta, J., Zhong, J., de Villiers, W. & Eckhardt, E. Chylomicrons promote intestinal absorption of lipopolysaccharides. Journal of Lipid Research 50, 90–97 (2009).
- Erridge, C., Attina, T., Spickett, C. M. & Webb, D. J. A high-fat meal induces low-grade endotoxemia: evidence of a novel mechanism of postprandial inflammation. Am. J. Clin. Nutr. 86, 1286–1292 (2007).
- Laugerette, F. et al. Emulsified lipids increase endotoxemia: possible role in early postprandial low-grade inflammation. J. Nutr. Biochem. 22, 53–59 (2011).
- Harris, H. W. et al. Chylomicrons alter the fate of endotoxin, decreasing tumor necrosis factor release and preventing death. J. Clin. Invest. 91, 1028–1034 (1993).
- Manco, M., Putignani, L. & Bottazzo, G. F. Gut microbiota, lipopolysaccharides, and innate immunity in the pathogenesis of obesity and cardiovascular risk. Endocr. Rev. 31, 817–844 (2010).
- Vreugdenhil, A. C. E. et al. Lipopolysaccharide (LPS)-binding protein mediates LPS detoxification by chylomicrons. J. Immunol. 170, 1399–1405 (2003).
- Parlesak, A., Schaeckeler, S., Moser, L. & Bode, C. Conjugated primary bile salts reduce permeability of endotoxin through intestinal epithelial cells and synergize with phosphatidylcholine in suppression of inflammatory cytokine production. Crit. Care Med. 35, 2367–2374 (2007).
- Pinto, A., Bonucci, A., Maggi, E., Corsi, M. & Businaro, R. Anti-Oxidant and Anti-Inflammatory Activity of Ketogenic Diet: New Perspectives for Neuroprotection in Alzheimer’s Disease. Antioxidants (Basel) 7, (2018).
- Keating, N. & Keely, S. J. Bile acids in regulation of intestinal physiology. Curr Gastroenterol Rep 11, 375–382 (2009).
- Lorenzo‐Zúñiga, V. et al. Oral bile acids reduce bacterial overgrowth, bacterial translocation, and endotoxemia in cirrhotic rats. Hepatology 37, 551–557 (2003).
- Kidd, M. et al. Luminal regulation of normal and neoplastic human EC cell serotonin release is mediated by bile salts, amines, tastants, and olfactants. Am. J. Physiol. Gastrointest. Liver Physiol. 295, G260-272 (2008).
- Singh, S. B. & Lin, H. C. Hydrogen Sulfide in Physiology and Diseases of the Digestive Tract. Microorganisms 3, 866–889 (2015).
![]()